
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ПЕРЕДМОВА. До лабораторного практикуму
|
|
СЕКЕРЕШ К.Ю., БОГОСТА А.С.
МЕДИЧНА ХІМІЯ
(ФІЗИЧНА, КОЛОЇДНА ТА БІОНЕОРГАНІЧНА ХІМІЯ)
Посібник
До лабораторного практикуму
для студентів медичного факультету
УЖГОРОД - 2007
Відповідальний за випуск Гомонай В.І.
Рекомендовано методичною комісією
хімічного факультету (Протокол № від 00.00.2007)
 | ||
 |
ПЕРЕДМОВА
Мета посібника – допомогти студенту добре оволодіти матеріалом при вивченні фізичної хімії. Самостійна робота над предметом є особливо ефективною, якщо знайдена зручна форма самоконтролю за розумінням і засвоєнням матеріалу, який вивчається. Посібник дає можливість максимально здійснювати такий контроль.
Матеріал викладено логічно, послідовно, згідно з програмою вив-
чення фізичної хімії.
Усі методичні вказівки ставлять конкретну мету перед студентом, містять конкретні завдання, які студент повинен виконати при вивченні даної теми.
При оформленні протоколу результатів лабораторного дослідження студент зобов’язаний дотримуватись певних вимог запису:
- дата заняття;
- № протоколу;
- тема заняття;
- назва лабораторної роботи;
- мета та суть методу;
- результати роботи і висновок.
У висновках аргументуються одержані експериментальні дані і пояснюється їх суть та роль того чи іншого процесу для виробництва.
І. ОБРОБКА ТА ОФОРМЛЕННЯ РЕЗУЛЬТАТІВ ЛАБОРАТОРНИХ РОБІТ
ОФОРМЛЕННЯ ЗВІТУ
Звіт з кожної лабораторної роботи складається за такою схемою:
1. Назва роботи.
2. Мета роботи (мету роботи з теоретичним поясненням викладають чітко і дуже стисло).
3. Методика виконання (коротко записують послідовність проведення досліду, креслять схему установки).
4. Результати дослідів і їх обробка (подають у формі таблиць, розрахунків та графіків).
ВИРАЖЕННЯ РЕЗУЛЬТАТІВ ВИМІРЮВАНЬ У ФОРМІ
ТАБЛИЦЬ І ГРАФІКІВ
Для аналізу результатів досліджень експериментальні та розра-
хункові величини записують у таблиці або подають у вигляді графіків. Як правило, дослідні дані зводять у таблиці, далі будують графіки, а потім (якщо в цьому є потреба) записують у вигляді відповідних рівнянь.
СКЛАДАННЯ ТАБЛИЦЬ
Будь-які вимірювання мають щонайменше дві змінні величини, одну з яких задають (незалежна величина – аргумент), а інша або інші – залежна або залежні (функції).
В таблицях аргумент і функції треба розміщувати по одній горизонталі, кожну в своєму стовпчику. Кожному стовпчику потрібно дати заголовок і зазначити одиниці вимірювання.
ПОБУДОВА ГРАФІКІВ
При обробці експериментальних даних широко застосовуються графічні методи, які дають наочну ілюстрацію взаємозв’язку між досліджуваними величинами.
Для графічного зображення результатів вимірювання застосову-
ють, як правило, систему прямокутних координат. Побудова графіків спрощується при використанні міліметрового паперу або спеціальних видів координатного паперу, наприклад логарифмічного. При можливості, результати можна оформити на комп’ютері, користуючись програмою "Origin - 5" або іншими подібними програмами (Origin – 3,5 тощо).
ВИБІР МАСШТАБУ
1. Масштаб при побудові графіків вибирають так, щоб координати будь-якої точки було легко і швидко визначити. Найзручніше виби-
рати такий масштаб, щоб 1 см був прийнятий за 1, 10, 100...10n одиниць або за одну, дві чи п’ять одиниць.
2. Масштаб треба вибирати так, щоб крива на графіку займала практично все вільне поле між координатами (віссю абцис і вісю ординат). Якщо кривих декілька, масштаб необхідно роз-
раховувати таким чином, щоб всі вони розмістилися в полі коорди-
натної системи.
3. При нанесенні масштабу слід вказувати розмірність.
4. При виборі шкали не обов’язково починати з нульового зна-
чення: шкала може починатись такими округлими значеннями, щоб всі вимірювані величини знаходились в інтервалі між цими значен-
нями.
Точки на графіках треба наносити ретельно і чітко, обводячи їх кружечками, квадратиками, трикутниками тощо. Точки, які належать до однієї групи вимірювань (для однієї кривої), позначають однаково, точки різних груп – по-різному.
Криву через зазначені точки слід проводити так, щоб вона була плавною і проходила якомога ближче до всіх точок, але не обов’язко-
во, щоб вона перетинала всі точки.
У випадку використання компютеру криві виконують по команді "Splaine"
ПРАКТИЧНІ ПОРАДИ
Виконання кожної роботи в лабораторії проходить такі стадії:
1) теоретична підготовка виконавця (студента) до експерименту;
2) підготовка об’єкта і установки до досліду та виконання самого досліду;
3) теоретична обробка результатів досліду та їх оцінка.
При теоретичній підготовці до виконання експерименту, зазда-
легідь користуючись відповідними підручниками, потрібно:
а) засвоїти основні теоретичні положення даної роботи. Наприк-
лад, досліджуючи електропровідність розчинів електролітів, треба добре розуміти теорію електролітичної дисоціації; досліджуючи електрорушійні сили, слід розібратися в основних положеннях теорії гальванічних елементів; а готуючись до дослідження осмотичного тиску розчинів, вивчити теорію розчинів;
б) засвоїти закони, що лежать в основі досліджуваного явища (наприклад, закони про теплові ефекти при згоранні, розчиненні речовин тощо). Закони треба опрацювати так, щоб свідомо і безпомилково їх формувати і вміти застосовувати до природних явищ;
в) добре опрацювати математичні рівняння, що дають кількісну характеристику явищ і встановлюють певний математичний зв’язок між досліджуваними величинами;
г) вивчити будову приладів та установок, на яких доведеться вико-
нувати експериментальне досліджування; користуючись літературни-
ми джерелами, слід навести схеми цих приладів (принцип дії), ознайомитись з ними в лабораторії, знати назву та призначення кожної деталі;
д) готуючись до виконання роботи в лабораторії, треба якнай-
краще продумати методику досліду; якщо теоретичну частину можна вивчати за підручниками, то методику виконання експерименту – за відповідними посібниками до лабораторних робіт;
е) заздалегідь підготувати форми таблиць, куди записуватимуться результати вимірювань під час експерименту. Чим краще підготується експериментатор до виконання роботи, тим досконаліше він складе форму таблиці (чи таблиць) для запису спостережень.
ІІ. ПРАВИЛА РОБОТИ В ЛАБОРАТОРІЇ з ФІЗИЧНОЇ ХІМІЇ І ТЕХНІКА БЕЗПЕКИ
Успішне виконання лабораторного практикуму можливе лише при дотриманні правил роботи в лабораторії, вимог техніки безпеки та охорони праці.
1. При всіх роботах зберігати максимальну обережність, пам’я-
таючи, що неакуратність, неуважність, недостатнє ознайом-
лення з приладами і властивостями речовин може викли-
кати нещасний випадок.
2. Хімічні реакції проводити тільки з такими кількостями і концентраціями кислот, в такому посуді і в таких умовах, як це вказано в інструкції.
3. Під час роботи дотримуйтесь чистоти, тиші, порядку і пра-
вил техніки безпеки. Не займайтесь сторонніми розмовами, працюйте вдумливо, будьте обережними. Категорично забо-
роняється відвідування студентів, які працюють в лабора-
торії, сторонніми особами або відволікання сторонньою роботою. По закінченні роботи приведіть робоче місце в порядок і здайте черговому по лабораторії.
4. Категорично забороняється виливати в раковину залишки концентрованих кислот, лугів, неприємних на запах і вогне-
небезпечних органічних рідин, кидати в раковини папір, вату, сірники, осади та інші тверді речовини. Використо-
вуйте для цього спеціально призначені склянки.
5. При нагріванні і кип’ятінні рідин у пробірці отвір спря-
мовуйте в бік як від того, хто працює, так і від сусідів, при цьому не заглядайте в пробірку або колбу, тому що від можливого викидання нагрітої речовини можуть бути не-
щасні випадки. Категорично забороняється нагрівати заку-
пореними будь-які посудини.
6. Нагрівання легкогорючих рідин (етер, петролейний естер, бензин, ацетон, бензен, спирт та інші) проводьте тільки на водяній бані, а не на відкритому вогні. Не можна запалю-
вати вогонь у безпосередній близькості від цих речовин. Категорично забороняється ставити склянки з горючими і легкозаймистими речовинами поблизу запаленого пальника.
7. При роботі з кислотами твердо пам’ятайте правила змішу-
вання сірчаної кислоти з водою: сірчану кислоту вливайте в воду невеликими порціями, а не навпаки. Концентровані кислоти і луги ні в якому разі не засмоктуйте піпетками. Для цього користуйтесь гумовими грушами. Слідкуйте за тим, щоб не облити обличчя й одяг.
8. Щоб уникнути вибуху, обрізки металічного натрію і калію ні в якому разі не викидайте в раковину. Їх необхідно збирати в спеціальні склянки з газом.
9. При роботі з лужними металами, їдкими лугами, кислотами, вибуховими речовинами або їх сумішами, а також при всіх інших роботах, пов’язаних з небезпекою для очей, одягайте захисні окуляри.
10. Ніякі речовини в лабораторії не пробуйте на смак. При визначенні запаху не можна вдихати парів, які виділяються. Нюхати слід обережно, не вдихаючи глибоко, а спрямо-
вуючи до себе пари або гази рухом руки.
11. Категорично забороняється працювати в лабораторії само-
му при відсутності лаборанта або викладача.
ЛІКВІДАЦІЯ НЕЩАСНИХ ВИПАДКІВ
І НАДАННЯ ПЕРШОЇ ДОПОМОГИ
При виникненні пожежі негайно загасіть газові пальники, вимкніть електронагрівальні прилади, приберіть усі горючі речовини і склянки з горючими речовинами, швидко засипте піском або накрийте вовняною ковдрою осередок пожежі. Великі осередки пожежі гасіть вогнегасником. Водою можна гасити лабораторні меблі (столи, полиці, табуретки, шафи і т.д.). Етер, бензин, бензен, металічний натрій заливати водою ні в якому разі не дозволяється.
Якщо на працюючому загориться одяг, негайно на нього накиньте вовняну ковдру, пальто чи піджак, дуже добре поливайте водою.
У випадку термічного опіку до ураженого місця негайно при-
кладіть вату, змочену етиловим спиртом, 5%-ним розчином марган-
цевокислого калію або 5%-ним розчином таніну, потім накладіть мокру пов’язку з такого ж розчину. При дуже сильних опіках уражене місце після обробки спиртом покрийте ватою, змоченою льняним маслом або маззю від опіків.
При опіках кислотами або їдкими лугами спочатку добре проми-
вають обпечене місце великою кількістю води з-під крану, потім, у випадку обпечення кислотою, промивають 3%-ним розчином бікарбо-
нату натрію, а коли попадає луг – 2%-ним розчином оцтової кислоти. При сильних опіках шкіри кислотами або лугами після обмивання накладають пов’язку, змочену розчином марганцевокислого калію або таніту, чи змазують маззю від опіків або вазеліном.
При попаданні кислоти в очі, їх промивають великою кількістю води, а потім 3%-ним розчином бікарбонату натрію. У випадку попадання лугу в очі спочатку промивають великою кількістю води, а потім насиченим розчином борної кислоти, після чого закапують в очі краплю касторового масла.
При опіках шкіри бромом необхідно негайно змити бром великою кількістю води або спирту і змазати обпечене місце маззю від опіків або обтерти гліцерином. Фенол із шкіри змивають спиртом або бен-
зеном.
При отруєнні хлором чи бромом необхідно вдихати пари спирту або аміаку, а потім вийти на свіже повітря.
При порізах склом обов’язково виймають осколки скла з рани, змазують поранене місце 3%-ним спиртовим розчином йоду і накла-
дають пов’язку.
У всіх випадках поранення, опіків і отруєння, після надання пер-
шої допомоги, негайно направляють потерпілого в поліклініку.
ІІІ. АГРЕГАТНИЙ СТАН РЕЧОВИН
1. ВИЗНАЧЕННЯ МАСИ МОЛЯ РЕЧОВИНИ ВИМІРЮВАННЯМ
ЇЇ ОБ’ЄМУ В ГАЗОПОДІБНОМУ СТАНІ
Для роботи необхідно: прилад для випаровування речовини і замірю-
вання об’єму пари даної речовини; аналітичні терези; плитка електрична; ампули, що заповнюються досліджуваною речовиною; термометр кімнат-
ний; барометр – анероїд.
Метод визначення густини пари і молекулярного об’єму речовини в па-роподібному стані при нормальних умовах, тобто при 273 К і 1,013×105 Па, ґрунтується на застосуванні газових законів для твердих і рідких речовин, переведених у газоподібний стан.
Для знаходження густини пари по вищезгаданому методу визначають об’єм відомої маси речовини, переведеної в газоподібний стан.
Знаючи масу пари, яка при температурі Т і тиску Р займає об’єм V, можна вирахувати густину do. Для цього виміряний об’єм приводять до нормальних умов, користуючись рівнянням Клапейрона:
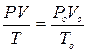 , ,
|
звідки
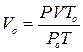 .
.
При нормальних умовах одержують густину пари:
 ,
,
де g – наважка речовини, кг.
Т,V,Р – температура, об’єм і тиск пари речовини в умовах досліду.
Користуючись рівнянням Менделєєва – Клапейрона, можна вираху-
вати молекулярну вагу речовини
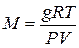 .
.
По молекулярній вазі речовини і густині його пари при нормальних умовах обчислюють молекулярний об’єм речовини в пароподібному стані за формулою
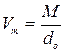 .
.
Точність розглянутого методу не перевищує 1%, так як при розрахунках користуються газовими законами, справедливими лише для ідеальних газів.
Досліджувані пари значно відхиляються від цих законів при темпе-
ратурах, близьких до точок кипіння досліджуваних речовин.
Суть методу полягає в наступному.
Точно відважену кількість речовини (не більше 0,1–0,2 г) випаро-
вують в особливому приладі при температурі, що не менше ніж на 293 К перевищує її температуру кипіння. Пари досліджуваної речовини витіс-
няють з приладу в газовимірювальну бюретку об’єм повітря V, рівний об’є-му парів досліджуваної речовини. Даний об’єм знаходиться під тиском Р і кімнатній температурі Т.
Таким чином, експериментально визначають не об’єм пари дослід-
жуваної речовини, а рівний йому об’єм повітря, витісненого цими парами з приладу, причому вимірювання об’єму проводять при кімнатній темпера-
турі і під атмосферним тиском.
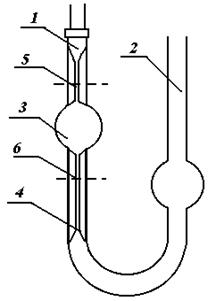
Прилад для визначення молекулярної маси схематично зображений на ри-сунку 1. Він уявляє собою циліндричний посуд 1, до якого припаяна трубка 2. До верх-ньої частини приладу припаяний відросток, кінець трубки під час досліду закривається гумовим корком 6. Посуд занурюється в металічну баню 3, заповнену водою в такій кількості, щоб його розширена частина була у воді. Воду нагрівають до кипіння для обігріву розширеної частини посуду.
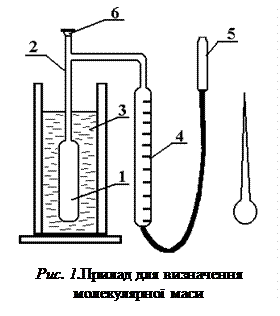 Якщо точка кипіння досліджуваної речовини вища 353 К, то воду замі-
Якщо точка кипіння досліджуваної речовини вища 353 К, то воду замі-
нюють висококиплячою речовиною. Га-
зовимірювальна бюретка 4 за допомо-
гою гумової трубки з’єднується одним кінцем з приладом, другим – із зрів-
нювальною склянкою 5.
Перед початком роботи вклю-
чають електроплитку для нагрівання водяної бані.
Робота починається з очистки посу-
ду від речовини, яка досліджувалась раніше, і продуванням його повітрям.
У чергового лаборанта одержують
три ампули, які зважують з точністю до 0,0001 г і повертають для заповнення їх досліджуваною речовиною. Заповнені ампули знову зважують з поперед-
ньою точністю. Різниця у масі заповненої і порожньої ампули дає масу взятої для досліду речовини.
Після інтенсивного кипіння води протягом деякого часу ампули мож-
на опустити в прилад, попередньо встановивши за допомогою зрівню-
вальної склянки 5 рівень води в газовимірювальній бюретці на нулеві.
Відломивши частину капіляру, ампулу головкою вниз кидають через верхній отвір приладу разом з відламаною частиною. При цьому швидко і старанно закривають отвір гумовим корком.
Речовина, що містилася в ампулі, випаровується. Пара витісняє з посуду 1 в газовимірювальну бюретку 4 об’єм повітря, рівний об’єму утвореної пари досліджуваної речовини. В результаті цього рівень води в бюретці понижується. Коли об’єм повітря в бюретці перестає змінюватися, що вказує на кінець випаровування, встановлюють рівні в бюретці і в зрівнюваній склянці точно по одній висоті. Відраховують об’єм витісне-
ного повітря, який відповідає об’єму речовини, переведеної в пару.
Відмічають температуру по кімнатному термометру і атмосферний тиск по барометру, що знаходиться в даній лабораторії.
Закінчивши один дослід, приступають до другого, третього. З одержа-
них даних знаходять середнє значення. Перед кожним дослідом проду-
вають прилад повітрям і очищають від уламків ампул, не припиняючи нагрівання водяної бані. Як вказано вище, густина пари при нормальних умовах дорівнює
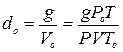 .
.
Повітря, яке знаходиться в бюретці над водою, насичується парами води. Вимірюваний атмосферний тиск Н урівноважується сумою парціаль-
ного тиску Р повітря, витісненого в бюретку, та пружності парів води, які насичують простір при температурі досліду:
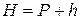 .
.
Повітря, що міститься в приладі, це кімнатне повітря, відносна вологість якого в лабораторних умовах коливається в межах 50%. Для свого насичення воно потребує тільки половину максимальної кількості води і, отже, створений ним парціальний тиск буде дорівнювати h/2.
Таким чином, витіснене в бюретку напіввологе повітря, займаючи весь об’єм V при кімнатній температурі Т, має тиск
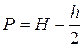 .
.
де h береться з таблиці, що подається в кінці опису.
Підставляючи значення тиску у вираз для густини пари, одержуємо:
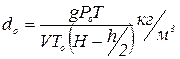 .
.
З рівняння
 , де
, де 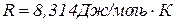
розраховують молекулярну масу речовини. Знаючи do і молекулярну масу речовини, визначають молекулярний об’єм досліджуваної речовини в газоподібному стані
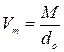 .
.
Коефіцієнти при змінних величинах g і V
 і
і 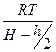
будуть однакові для всіх трьох вимірів і тому рекомендується, знаючи умови досліду, попередньо підрахувати значення цих коефіцієнтів і корис-
туватися ними при розрахунках густини і молекулярної маси.
Дослідні і розрахункові дані заносяться в табл. 1.
Таблиця 1
| № п/п | Вага порожньої ампули,10-3кг | Вага ампули з рідиною, 10-3кг | Наважка рідини, 10-3кг | Об’єм, 10-6м3 | Темпера-тура,К | Тиск по барометру, 1,0133·105Па | Пружність парів води | Тиск, 1,0133·105Па | Густина, кг/м3 | Мол. маса, кг/кмоль | Мол. об’єм, 10-6м3 |
Пружність парів води в залежності від температури наведено в табл. 2.
Таблиця 2
| Т, К | h | Т, К | h |
| 287,0 | 11,987 | 292,5 | 16,99 |
| 287,5 | 12,382 | 293,0 | 17,535 |
| 288,0 | 12,783 | 293,5 | 18,085 |
| 288,5 | 13,205 | 294,0 | 18,650 |
| 289,0 | 13,634 | 294,5 | 19,231 |
| 289,5 | 14,076 | 295,0 | 19,827 |
| 290,0 | 14,530 | 295,5 | 20,440 |
| 290,5 | 14,997 | 296,0 | 21,068 |
| 291,0 | 15,477 | 296,5 | 21,714 |
| 291,5 | 15,971 | 297,0 | 22,377 |
| 292,0 | 16,477 | 298,0 | 23,765 |
2. ВИЗНАЧЕННЯ В’ЯЗКОСТІ СИСТЕМИ ЕТИЛОВИЙ СПИРТ – ВОДА
Для роботи необхідно: суміші компонентів етиловий спирт – вода: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100%; чисті компоненти: вода, етиловий спирт; віскозиметр; піпетка на 5–10 мл; секундомір.
Даний метод визначення в’язкості ґрунтується на застосуванні фор-
мули, що виражає закон Пуазейля
 , звідки
, звідки 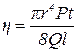 ,
,
де Q – об’єм рідини, що протікає за час t через капілярну трубку радіусом r і довжиною l;
P – тиск, при якому витікає рідина;
h – коефіцієнт внутрішнього тертя.
Безпосереднє визначення абсолютного коефіцієнту внутрішнього тер-
тя вимагає точного визначення всіх величин, які входять у формулу. Тому на практиці визначається не абсолютна величина h, а її відношення до h 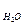 для такого ж об’єму води, що протікає при аналогічних умовах за час t. При витіканні різних рідин з одного і того ж капіляру тиск P буде величиною змінною, так як він в кожний момент рівний тиску стовпчика рідини, який ще не витік. Але закон зміни цього тиску з висотою для обох рідин буде один і той же.
для такого ж об’єму води, що протікає при аналогічних умовах за час t. При витіканні різних рідин з одного і того ж капіляру тиск P буде величиною змінною, так як він в кожний момент рівний тиску стовпчика рідини, який ще не витік. Але закон зміни цього тиску з висотою для обох рідин буде один і той же.
Тому можна записати:
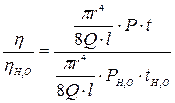 ,
,
де P, P 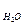 – тиск рідини, що витікає, і води при однакових висотах їх в капілярі.
– тиск рідини, що витікає, і води при однакових висотах їх в капілярі.
Оскільки тиск однакових стовпчиків двох рідин пропорційний їх густинам
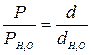 ,
,
то можна записати:
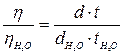 ,
,
звідки
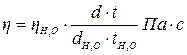 .
.
Користуючись цією формулою і підставляючи значення в Пуазах, можна визначити h витікаючої рідини. При 293 К h 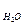 = 0,01 П або в системі СІ [h] = Н×с/м2.
= 0,01 П або в системі СІ [h] = Н×с/м2.
|
Нехай умовно h  при кімнатних умовах дорівнює 1. Густина води також приймається рівною 1. Значення густини суміші етиловий спирт–вода наведені в табл. 2.
при кімнатних умовах дорівнює 1. Густина води також приймається рівною 1. Значення густини суміші етиловий спирт–вода наведені в табл. 2.
Практична частина роботи зводиться до визначення часу витікання досліджу-ваної речовини і води.
Для визначення часу витікання рідини використовується віскозиметр, зображений на рисунку.
Він представляє собою з’єднані скляні трубки 1 і 2. Трубка 1 має розширення 3, що переходить у капіляр 4. Вище і нижче роз-ширення, зверху і знизу, є мітки 5 і 6 відпо-
відно.
У віскозиметр через трубку 2 нали-
вають піпеткою завжди один і той самий об’єм рідини. За допомогою гумової труб-
ки, сполученої з трубкою 1, витягують рідину через капіляр вище мітки 5. Час t, необхідний для пониження рівня рідини від мітки 5 до мітки 6, ви-
мірюють секундоміром. Таке вимірювання повторюють три рази і беруть середнє значення. Так само визначають час витікання води.
Будують графік у координатах в’язкість – концентрація.
Результати дослідів записують у табл. 1.
Таблиця 1
| Назва суміші і чистих компонентів | Густина, кг/м3 | Час виті-кання, с | Середнє значення часу витікання, с | Значення в’язкості, Н×с/м2 |
Таблиця 2
| % вміст спирту | Густина, r, кг/м3 |
| 989,6 | |
| 978,2 | |
| 965,5 | |
| 951,5 | |
| 934,3 | |
| 912,6 | |
| 887,1 | |
| 858,2 | |
| 826,0 | |
| 791,0 | |
| Н2О | 1000,0 |
I. ХІМІЧНА ТЕРМОДИНАМІКА
1. ВИЗНАЧЕННЯ ТЕПЛОТИ ЗГОРІННЯ РЕЧОВИН ЗА ДОПОМОГОЮ КАЛОРИМЕТРА ЮНКЕРСА
Для роботи необхідно: калориметр Юнкерса; сухий спирт; кон-
тактний термометр; барометр; технічна вага; мірний циліндр на 1 – 2 л; секундомір.
Мета роботи – визначення теплотворної здатності твердих, рідких і газоподібних горючих речовин. Для цього застосовується калориметр системи Юнкерса, так званий ручний калориметр, який зображений на рис.1.
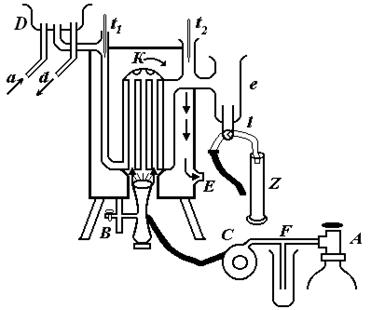
Рис.1.
В ньому можуть згорати гази (метан, етан, пропан, бутан), рідкі речовини (спирти) та тверді речовини (цукор, сухий спирт тощо). В кожному випадку на вході калориметра робиться спеціальний пристрій, за допомогою якого спалюють речовину: чи то в газовій горілці (як показано на рисунку 1), чи то в cпиртівці (рідкі речовини), або на спеціальній підставці спалюють тверді речовини (їх розміщують на металевій сіточці, вкритій азбестом). В залежності від агрегатного стану речовини, калорійність якої визначають, теплотворну здатність відносять або до одиниці об'єму (газуваті речовини), або до одиниці маси (рідкі і тверді речовини). Кількість спаленого газу вимірюють за допомогою газового лічильника, тоді як кількість рідини чи твердої речовини, яка згоріла під час досліду, визначають по різниці маси на початку і кінці досліду. В останньому випадку спиртовку зважують до досліду і після досліду (разом із спиртом), і знаходять різницю спирту, що випарувався і згорів. У випадку твердої речовини (сухий спирт) декілька кубиків речовини зважують перед дослідом, потім їх вміщують на підложку у входа до калориметра і підпалюють. Через певний час гасять полум'я і після охолодження залишкової маси її зважують. По різниці маси визначають кількість сухого спирту, який згорів під час досліду.
Розрізняють вищу і нижчу теплотворну здатність палива. Вища теплотворна здатність – це та кількість тепла, яка виділяється при згоранні органічної речовини з утворенням рідкої води (тобто враховується і та теплота, яка виділяється при конденсації води).
Нижча теплотворна здатність речовини – це теплота згорання з утворенням пароподібної води (коли частина теплоти виноситься з продуктами горіння у вигляді водяної пари).
Метою даної роботи є визначення вищої теплотворної здатності речовини. Визначення теплотворної здатності твердих і рідких речовин проводять у калориметричній бомбі при сталому об'ємі, тоді як визначення теплотворної здатності газоподібних речовин проводять у калориметрі Юнкерса при сталому тиску. Але цей калориметр може бути використаний і для вимірення калорійності твердих і рідких речовин, якщо його трохи переобладнати.
Принцип роботи такої установки: газ із балону поступає в прилад С, звідки проходить у пальник, закріплений у нижній частині калориметра К, де і згорає. У випадку твердих речовин замість горілки вставляють спеціальну підставку, на якій розміщена досліджувана речовина (сухий спирт). Протягом всього досліду через калориметр циркулює вода. Із крана через трубку a вода направляється в чашку D, звідки під деяким сталим тиском поступає в середину калориметра, виходить в чашку е і через кран l може відводитись у відлив або мірний циліндр. Надлишок води з чашки D відводиться зa допомогою трубки d теж у відлив.
Продукти горіння піднімаються по трубках, які є в корпусі кало-
риметра, і віддають тепло циркулюючій воді. Внаслідок цього температу-
ра води, яка проходить через калориметр, підвищується. Охолоджені продукти горіння спускаються вниз і виходять через вивідну трубку Е. Температура вхідної і вихідної води вимірюється з допомогою термометрів t1 і t2.
Для правильної роботи установки важливо, щоб вона була у вер-
тикальному положенні. Це контролюється по рівневі, який знаходиться на зовнішній стінці калориметра.
Кількість речовини, яка спалюється, визначають по різниці початкової mo і кінцевої маси mt:  .
.
Date: 2015-09-24; view: 499; Нарушение авторских прав