
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Експериментальна частина
|
|
Відкриванням водопровідного крана пускають воду в калориметр. Користуючись міткою на крані l, повертають його так, щоб, виходячи із калориметра, вода попадала у відлив.
Підпалюють сухий спирт і протягом 10–15 хвилин дома-
гаються сталості температур вхідної і вихідної води, весь час спосте-
рігаючи за горінням спирту. Температуру вхідної і вихідної води спостерігають на обох термометрах і записують через кожну хвилину протягом 5 хвилин. З одержаних даних знаходять середню температуру води. Потім повертають головку крана так, щоб вода витікала в циліндр Z ємністю 1 літр. Коли в циліндр витече 1 літр води, кран перекривають. По масі сухого спирту, що згорів, і масі води, що набрана в циліндр, і різниці в показниках термометра розраховують теплотворну здатність речовини. Для розрахунків необхідно знати також і барометричний тиск, пружність парів води при заданій температурі і кімнатну температуру.
Кількість тепла (в Дж), яке пішло на нагрівання води при згоранні певної маси речовини розраховують по формулі
 ,
,
де т – маса води, кг; С – теплоємність води, Дж/кмоль; Т1 – температура води (К) на вході калориметра; Т2 – температура води (К) на виході з калориметру.
Калорійність сухого спирту, розрахована на 1 кг, знаходять по формулі
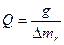 103.
103.
Дослід проводять при різній швидкості протікання води і вираховують середнє значення теплотворної здатності сухого спирту. Режим роботи вказується керівником заняття. Запис ведеться за такою формою (див. табл. 1):
| m = g = H = | h = Т, К = Q = |
Таблиця 1
| Початкова маса mo, к г | Кінцева маса mt, к г | ∆mr, к г | Температура води, Т К | Середня темпе- ратура води, Т К | ||
| що входить | що виходить | що входить | що виходить | |||
Пружність парів води в залежності від температури наведена в
табл. 2.
Таблиця 2
| Т К | h, мм рт.ст. | Т К | h, мм рт.ст. |
| 287,0 | 11,987 | 292,5 | 16,99 |
| 287,5 | 12,382 | 293,0 | 17,535 |
| 288,0 | 12,783 | 293,5 | 18,085 |
| 288,5 | 13,205 | 294,0 | 18,650 |
| 289,0 | 13,634 | 294,5 | 19,231 |
| 289,5 | 14,076 | 295,0 | 19,827 |
| 290,0 | 14,530 | 295,5 | 20,440 |
| 290,5 | 14,997 | 296,0 | 21,068 |
| 291,0 | 15,477 | 296,5 | 21,714 |
| 291,5 | 15,971 | 297,0 | 22,377 |
| 292,0 | 16,477 | 298,0 | 23,765 |
2. ВИЗНАЧЕННЯ ТЕПЛОТИ РОЗЧИНЕННЯ І ТЕПЛОТИ ГІДРАТАЦІЇ СОЛІ
Для роботи необхідно: калориметр; термометр; мішалка; пробірка для солі; дистильована вода; секундомір; сіль для розчинення; джерело струму; амперметр; вольтметр; електрообігрівач.
Мета роботи:
1. Визначення теплоємності калориметричної системи методом електро-
обігріву.
2. Визначення питомої теплоємності розчинення солі.
3. Визначення інтегральної теплоти розчинення, тобто теплового ефекту розчинення одного моля солі в такій кількості розчинника, коли Q буде постійним – Q інт.
4. Визначення теплоти гідратації солі – питомої і віднесеної до одного моля солі.
Тепловий ефект розчинення солі в великій кількості води дорівнює двом тепловим ефектам: зміні тепловмісту солі при руйнуванні криста-
лічної гратки Q 1, що зв’язано з поглинанням тепла і зміною тепловмісту при розчиненні частинок у розчиннику, що зв’язано з виділенням тепла Q 2:
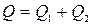 .
.
В залежності від співвідношення величин відповідних ефектів, тепло-
вий ефект розчинення може мати додатне або від’ємне значення. Тепловий ефект розчинення солей у воді здебільшого ендотермічний, тобто процес розчинення супроводжується поглинанням тепла і температура розчину понижується. Дуже рідко спостерігається екзотермічний тепловий ефект. Теплота розчинення заданої солі в заданому розчиннику може змінюва-
тися, якщо змінювати кількість взятої солі і розчинника.
Визначивши теплоти розчинення солей, можна визначити і теплоту гідратації солі. Теплотою гідратації називають кількість тепла, яку сис-
тема повинна одержати для утворення одного грам-моля твердого крис-
талогідрату з твердої безводної солі і відповідної кількості води. Якщо визначити послідовно тепловий ефект розчинення твердої безводної солі і тепловий ефект розчинення кристалогідрату, то із різниці можна знайти теплоту гідратації
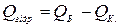 ,
,
Q Б. – тепловий ефект розчинення безводної солі;
Q К. – тепловий ефект розчинення кристалогідрату з молекули води.
Для визначення теплоти розчинення користуються калориметром з електрообігрівачем. При визначенні теплоємності системи виходять з того, що на систему подають певну кількість тепла електрообігрівом Qтеор. і відраховують зміну температури D t.
Для проведення експерименту збирають прилад (калориметр). У склян-ку наливають 300 г дистильованої води (тобто 300 мл, враховуючи, що густина води при температурі досліду приблизно дорівнює 1). Склянку з мішалкою ставлять у калориметр і закривають кришкою. На кришці калориметру закріплена спіраль для обігріву. Зважують певну кількість солі (на технічних терезах), висипають її в суху пробірку і вставляють у калориметр через отвір на кришці, щоб сіль прийняла температуру калориметричної установки. (Сіль і наважка солі вказується керівником заняття). Коли калориметрична установка зібрана, починають налагод-
жувати термометр Бекмана. Термометр занурюють у воду через отвір на кришці і спостерігають за рівнем ртуті в капілярі. Рівень ртуті повинен знаходитись у нижній частині шкали. (Термометр не повинен торкатись спіралі, стінок стакану, пробірки і мішалки). Якщо рівень ртуті вищий одного градуса, або весь капіляр заповнений ртуттю, то це означає, що її багато в нижньому резервуарі і надлишок її необхідно перелити у верхній резервуар.
 Для цього термометр ставлять похило, щоб нижній резервуар знахо-
Для цього термометр ставлять похило, щоб нижній резервуар знахо-
дився вище верхнього, і трошки підігрівають (торкнувшись рукою ниж-
нього резервуару). Коли частина ртуті перейде у верхній резер-
вуар, стовпчик ртуті розривають. Для цього затискують нижній кі-
нець термометра в руці і легким постукуванням руки по столу роз-
ривають ртуть у капілярі. Пере-
ливання роблять до тих пір, поки при даних умовах ртуть не зупи-
ниться в середині шкали термо-
метра Бекмана. Якщо ртуть зна-
ходиться нижче поділок шкали або зовсім не заповнює капіляр, отже при даних умовах ртуті недостатньо і її потрібно пере-
лити із верхнього в нижній резер-
вуар, тоді швидко перегортають термометр верхнім резервуаром вниз і з’єднують ртуть. Потім обережно перегортають термометр, тримаючи його похило, так, щоб запасний резервуар знаходився вище основного. Коли необхідна кількість ртуті перейде з верхнього резервуару в нижній, стовпчик ртуті розривають, як вказано вище.
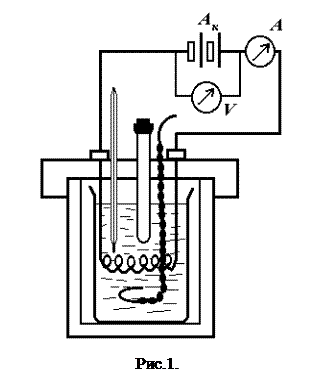
Налагоджений термометр вставляють у прилад і приступають до складання електричної схеми (рис. 1). Джерело струму включається тільки після перевірки електричної схеми керівником занять.
Після цього приступають до виконання експерименту. Переміщуючи рідину в калориметрі, включаючи секундомір, починають відлік темпе-ратури по термометру. Температура змінюється внаслідок теплообміну із зовнішнім середовищем. Відлік ведуть кожні півхвилини протягом
5 хвилин – це початковий період. Записавши час і покази термометра останнього відліку початкового періоду, включають струм на 3 хвилини і продовжують відлік через кожні півхвилини. При цьому для рівномірного обігріву води в стакані проводять її перемішування. Починаючи з часу включення струму, проходить нерівномірна зміна температури. Струм відключають і рівномірне падіння температур відраховують протягом
5 хвилин (через кожні півхвилини) – це кінцевий період.
Вмикання і вимикання струму проводять три рази і кожного разу записують покази приладів. Після третього вимикання струму, продов-
жуючи відлік, швидко висипають сіль з пробірки в стакан з водою і енергійно перемішують. При цьому сіль буде швидко розчинятись. Для більш точного визначення D t нагрівання і D t розчинення результати трьох періодів і чотирьох циклів безперервного відліку зміни температури з часом (три цикли і один цикл розчинення солі) заносяться на графік рис. 2.
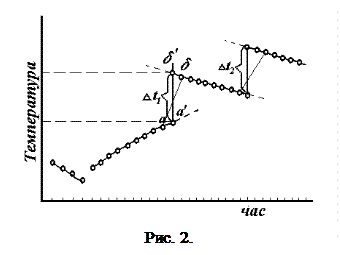 По осі абсцис відкладають час, по осі ординат – темпера-туру (тобто покази термометра). Прямі початкового і кінцевого періодів екстраполюють, тобто продовжують до середини діа-
По осі абсцис відкладають час, по осі ординат – темпера-туру (тобто покази термометра). Прямі початкового і кінцевого періодів екстраполюють, тобто продовжують до середини діа-
грами. Проміжок часу голов-
ного періоду ділять пополам і з цієї точки проводять пряму, па-
ралельну осі ординат до пе-
ретину з обома екстрапольо-
ваними прямими. Відрізок між двома точками перетину відповідає підвищенню температури D t для даного циклу. Аналогічно знаходять D t для всіх циклів досліду.
Дійсну температуру D tнар. знаходять як середнє арифметичне
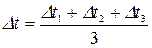 .
.
D t розчинення визначають аналогічно. Якщо після нагрівання на шкалі термометра далі не можна заміряти зміну температури розчинення солі, то дослід після нагрівання зупиняють. Термометр налагоджують на відповідні поділки шкали і проводять цикл розчинення солі.
Знаючи D t нагрівання, вираховують кількість тепла, яка одержана водою під час її нагрівання
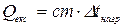 ,
,
де с – питома теплоємність води, яку приймають за одиницю;
т – вага води, яка дорівнює її об’єму 300 мл.
Підставляючи ці значення, одержимо
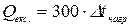 .
.
Ця кількість тепла менша за Qтеор., у зв’язку з поглинанням тепла системою. Qтеор. можна розрахувати, виходячи з закону Джоуля – Ленца.
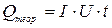 (Дж).
(Дж).
Виміряючи силу струму І в амперах, напругу U – у вольтах, а час проходження струму t – в секундах, визначають кількість тепла в джоулях.
Із розрахованої теоретичної кількості тепла віднімають кількість тепла, що одержана експериментально і різницю перераховують на 1 К. Це і буде кількість, яка поглинається всіма частинами калориметру – Ск.
Розраховують її, виходячи з пропорції
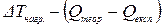 ,
,
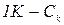 ,
,
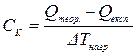 .
.
Загальна теплоємність системи дорівнює
 .
.
де Срід. – теплоємність калориметричної рідини, яка дорівнює:
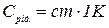 ,
,
С – питома теплоємність розчину, приблизно дорівнює одиниці. Масу розчину приймають рівною об’єму, тобто 300 мл. Тоді Срід можна прийняти рівною 1293,6 Дж, отже
 .
.
Визначивши по графіку D t розч. і розрахувавши теплоємність калориметричної системи, знаходять тепловий ефект розчинення взятої наважки солі:
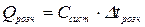 .
.
Тепловий ефект розчинення, віднесений до одного грама розчиненої речовини, дає питому теплоту розчинення:
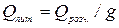 ,
,
де g – наважка солі в грамах. Молекулярна теплота розчинення дорівнює:
 ,
,
де М – молекулярна маса солі.
Для визначення молекулярної теплоти гідратації знаходять моле-
кулярну теплоту розчинення безводної солі і кристалогідрату цієї солі. Різниця одержаних молярних теплот і буде теплотою гідратації
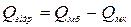 .
.
Кристалогідрат розчиняють не в 0,3 кг води, а в кількості, меншій на величину, яка міститься в наважці кристалогідрату.
Правильність результатів роботи перевіряється керівником занять.
Результати досліду записуються у табл. 1 і 2:
Таблиця 1
| Наважка б/в солі,10-3 кг | Мол. маса б/в солі, кг/кмоль | Наважка криста- логідрату, 10-3 кг | Молекулярна маса кристалогідрату, кг/кмоль | Об’єм розчин- ника, 10-6м3 | Сила струму, А | Напруга, В | Час, за який проходить струм, с | Q теоретичне, Дж | Зміна температури при нагріванні, К | Середнє значення зміни температури, К | Q практичне, Дж | Теплоємність калометр. сист., Дж | |
| I1= I2= I3= Icep= | U1= U2= U3= Ucep= | t1= t2= t3= | DТ1= DТ2= DТ3= |
Таблиця 2
| Зміна температури при розчиненні, К | Теплота розчинення, Дж | Теплота гідратації, Дж | ||||||||
| б/в солі | кристалогідрату | |||||||||
| б/в солі | крис- тало-гідрату | Q | QT | QM | Q | QT | QM | Q | QT | QM |
V. ПОВЕРХНЕВІ ЯВИЩА (ПОВЕРХНЕВА ЕНЕРГІЯ, ПОВЕРХНЕВИЙ НАТЯГ ТА АДСОРБЦІЯ НА МЕЖІ РОЗДІЛУ ФАЗ)
1. ВИЗНАЧЕННЯ ПОВЕРХНЕВОГО НАТЯГУ РОЗЧИНІВ МЕТОДОМ ВІДЛІКУ КРАПЕЛЬ
(СТАЛАГМОМЕТРИЧНИМ МЕТОДОМ)
Для роботи необхідні: сталагмометр; пікнометр; стаканчик на 50 мл.
Вільна поверхнева енергія, вірніше, надлишок вільної енергії на одиницю площі поверхневого шару на межі розділу рідина – повітря, називається поверхневим натягом, а на межі розділу рідина – рідина – граничним натягом s.
Одиницями виміру поверхневого натягу може бути Дж/м2 у випадку, коли його розглядають як надлишок вільної енергії поверхні розділу двох фаз, що накопичується на цій поверхні за рахунок нескомпенсованих міжмолекулярних сил, і в Н/м у випадку, якщо розглянути роботу утво-
рення одиниці нової поверхні.
Існує декілька методів визначення поверхневого натягу.
Найбільш розповсюдженим методом є сталагмометричний (метод відліку крапель).
В основі методу лежить експериментально встановлене положення, що вага краплі, яка повільно відривається під дією сили тяжіння від кін-
чика вертикальної трубки сталагмометра, буде тим більшою, чим більший поверхневий натяг рідини на межі з повітрям.
Вважається, що сила поверхневого натягу F, що діє вертикально по колу трубки, приблизно рівна F = 2prs, підтримує краплю, зрівноважуючи її вагу P. У момент відриву краплі можна вважати ці сили рівними:
 ,
, 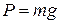 ,
,
де F – сила поверхневого натягу; P – сила ваги краплі; s – коефіцієнт пропорційності, який зв’язує силу поверхневого натягу з периметром
(в даному випадку, з довжиною кола капіляру, з якого витікає рідина).
При 2pr = 0,01 м коефіцієнт пропорційності рівний силі поверхневого натягу, тобто 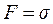 .
.
Визначення радіусу капіляру зв’язане з деякими труднощами і тому практично визначають поверхневий натяг відносно стандартної рідини з відомим поверхневим натягом. Стандартною рідиною може бути тільки така рідина, яка утворює краплі, близькі по об’єму до крапель дослід-
жуваної рідини.
При утворенні краплі сила поверхневого натягу досліджуваної речовини дорівнює F=2p rs (якщо вимірювання проводиться в одному і тому ж сталагмометрі).
Силу поверхневого натягу визначити важко, тому при експеримен-
тальних дослідженнях визначають вагу краплі, яка в момент відриву приблизно дорівнює силі поверхневого натягу.
Сила ваги одної краплі досліджуваної рідини
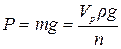 ,
,
де Vр – об’єм рідини, що витікає з сталагмометра;
ρ – густина рідини;
n – число крапель досліджуваної рідини в об’ємі;
g – прискорення сили земного тяжіння.
Аналогічний вираз при одному і тому ж об’ємі приладу можна записати і для стандартної рідини
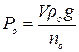 .
.
Беруть співвідношення цих рівнянь
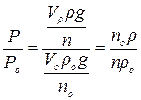 .
.
А так як
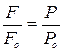 , тоді
, тоді 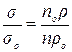 .
.
Розв’язавши це рівняння відносно поверхневого натягу досліджуваної речовини, одержуємо розрахункову формулу:
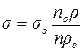 ,
,
де sо, ρo – поверхневий натяг і густина стандартної рідини.
Якщо за стандартну рідину береться вода, то sо при температурі дос-
ліду беруть з табл. 2, що знаходиться в кінці опису. ρo для води приблизно дорівнює одиниці.
При досліджуванні розведених розчинів (розчини ізоамілового спирту) густину ρ також можна прийняти за 1.
Густина концентрованих розчинів хлористого натрію береться з табл. 4, а густина води в залежності від температури – з табл. 3.
При дослідженні чистих рідин їх густину необхідно визначити. n, no – число крапель стандартної і досліджуваної речовини, визначається з допо-
могою сталагмометра.
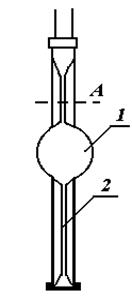
|
На рисунку схематично зображений сталагмо-
метр. Піпетка має розширену частину 1 і капіляр 2. Рідина, що витікає з сталагмометру, збирається в краплю, що звисає на нижньому, плоскому добре від-
шліфованому кінці сталагмометра. Крапля відри-
вається від поверхні диску в той момент, коли сила ваги її на незначну величину перевищує силу по-
верхневого натягу, що утримує краплю.
Визначення поверхневого натягу зводиться до відліку кількості крапель, що витікають з капіляру.
Через каучукову трубку, що знаходиться на верхньому кінці втягують рідину вище мітки. Відлік крапель починають тоді, коли рідина проходить міт-
ку. Відраховують число крапель від мітки до остан-
ньої краплини.
Спочатку проводять виміри із стандартною рідиною, якщо це вода, то немає необхідності сушити сталагмометр при переході до водних розчинів. Визначення ведуть, починаючи з розбав-
лених розчинів, переходячи до більш концентрованих. Для кожного роз-
чину визначення кількості крапель проводять не менше трьох разів і знаходять середню кількість крапель. З одержаних даних розраховують поверхневий натяг розчинів поверхнево-активних і поверхнево-неактивних речовин. Будують ізотерму поверхневого натягу в координатах  .
.
Результати досліду і розрахункові дані записуються в табл. 1.
Таблиця 1
| Кількість крапель | Густина, кг/м3 | Поверхневий натяг, Н/м×10-2 | |
| Дослід | Середнє значення | ||
Таблиця 2
Поверхневий натяг води в залежності від температури
| Т, К | Поверхневий натяг води, Н/м×10–2 |
| 75,64 | |
| 74,22 | |
| 72,75 | |
| 71,18 | |
| 69,56 | |
| 67,91 | |
| 66,18 |
Таблиця 3
Густина води в залежності від температури
| Т, К | Густина, кг/м3 | Т, К | Густина, кг/м3 | Т, К | Густина, кг/м3 |
| 1000,00 | 999,40 | 997,80 | |||
| 999,99 | 999,30 | 997,65 | |||
| 999,97 | 999,13 | 997,32 | |||
| 999,93 | 998,97 | 997,07 | |||
| 999,88 | 998,80 | 996,81 | |||
| 999,81 | 998,62 | 996,54 | |||
| 999,73 | 998,43 | 996,26 | |||
| 999,63 | 998,23 | 995,97 | |||
| 999,52 | 998,02 | 995,67 |
Таблиця 4
Густина розчинів NaCl при 293 К
| Конц. NaCl, н. | Густина, кг/м3 |
| 0,1 | 994,7 |
| 0,25 | 1003,1 |
| 0,5 | 1018,5 |
| 1,0 | 1032,8 |
2. ВИЗНАЧЕННЯ ПЛОЩІ ТА ДОВЖИНИ МОЛЕКУЛИ ПОВЕРХНЕВО-АКТИВНОЇ РЕЧОВИНИ
Для виконання роботи потрібно визначити поверхневий натяг декіль-
кох розчинів поверхнево-активної речовини різної молярної концентрації (за вказівкою викладача). Вимірювання поверхневого натягу проводять сталагмометричним методом, як описано вище.
Для визначення величини адсорбції находять різницю величини по-
верхневого натягу s2 і s1, які виміряли для двох сусідніх розчинів різної молярної концентрації с2(Х) і с1(Х). Цю різницю s2 – s1 = Ds і с2(Х) – с1(Х)=Dс(Х) підставляють у рівняння Гіббса:
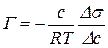 ,
,
де Г – величина адсорбції, моль/м2;
с(х) – молярна концентрація поверхнево-активної речовини, моль/м3;
R – газова стала, дорівнює 8,31 Дж/моль.К;
Т – абсолютна температура, К;
σ – поверхневий натяг, Дж/м2.
В цьому випадку в якості с(х) беруть середнє арифметичне 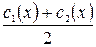 . Потім розраховують сср.(х) і будують графік залежності
. Потім розраховують сср.(х) і будують графік залежності 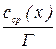 (вісь ординат) від сср.(х) (вісь абсцис). Проводять пряму, за тангенсом кута якої знаходять Г.
(вісь ординат) від сср.(х) (вісь абсцис). Проводять пряму, за тангенсом кута якої знаходять Г.
Одержані дані заносять в таку таблицю:
| №№ п/п | с(х), моль/м3 | σ, Дж/м2 | сср.(Х), моль/м3 | Δс(Х), моль/м3 | Δσ, Дж/м2 | Г, моль/м2 | сср.(Х) моль/м3 |
Розрахувати площу (S) і довжину (l) молекули поверхнево-активної речовини:
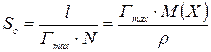 ,
,
де N – постійна Авогадро, дорівнює 6,02×1023 моль–1;
Гmax – величина граничної адсорбції, моль/м2;
М(Х) – молярна маса ПАР, кг/моль;
ρ – густина ПАР, кг/м3.
3. АДСОРБЦІЯ ОЦТОВОЇ КИСЛОТИ НА АКТИВОВАНОМУ ВУГІЛЛІ
Ізотерми адсорбції ряду речовин із розчину на поверхні твердого тіла в області середніх концентрацій задовільно описуються емпіричним рів-
нянням Фрейндліха:
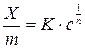 , (1)
, (1)
де Х – кількість адсорбтиву, ммоль;
m – маса адсорбенту, кг;
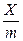 – величини адсорбції, кмоль/кг;
– величини адсорбції, кмоль/кг;
К і 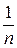 – емпіричні константи, залежні від природи адсорбенту і адсорбативу;
– емпіричні константи, залежні від природи адсорбенту і адсорбативу;
с – рівноважна молярна концентрація адсорбативу, моль/м3.
Величина адсорбції 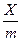 або а розраховується за формулою:
або а розраховується за формулою:
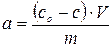 . (2)
. (2)
Якщо прологарифмуємо рівняння (1), то воно набуде вигляду:
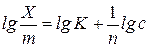 . (3)
. (3)
Одержане рівняння є рівнянням прямої лінії.
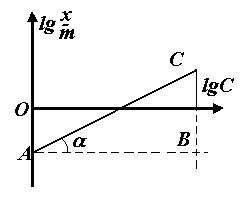 Для визначення К і
Для визначення К і  находять логарифми значень с і
находять логарифми значень с і 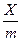 і будують графік (див. рисунок: по осі абсцис lg c, а по осі ординат lg
і будують графік (див. рисунок: по осі абсцис lg c, а по осі ординат lg 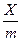 ). Величина відрізку АО дорівнює lg K. За значенням логарифму находять К. Постійна
). Величина відрізку АО дорівнює lg K. За значенням логарифму находять К. Постійна  дорівнює tg α або відношенню довжин відрізків СВ і АВ, тобто
дорівнює tg α або відношенню довжин відрізків СВ і АВ, тобто 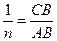 .
.
Методика експерименту
У чотири колбочки вносять по 1 г активованого вугілля і наливають із бю-
ретки по 25 мл розчинів оцтової кис-
лоти різної молярної концентрації (0,05; 0,1; 0,2; 0,4 моль/л). Колбочки пері-одично збовтують близько 20 хвилин. Потім розчини фільтрують через папе-рові фільтри в сухі колбочки, відкидаючи перші 3–5 мл фільтрату (для уникнення похибок за рахунок адсорбції кислоти на фільтрі). Рівноважну молярну концентрацію кислоти у фільтраті визначають титруванням 5 мл розчину розчином NaOH (c(NaOH) = 0,1 моль/л) у присутності фенол-
фталеїну. Кожний розчин титрують 2–3 рази. Потім за формулою (2) розраховують величину адсорбції оцтової кислоти, а також находять lg c i lg 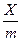 . Результати розрахунків заносять у таку таблицю:
. Результати розрахунків заносять у таку таблицю:
| со, моль/м3 | с, моль/м3 | Х/m, кмоль/кг | lgc | lgX/m | K | 1/n |
Користуючись даними таблиці, будують ізотерму адсорбції оцтової кислоти, при цьому на осі абсцис відкладають рівноважну молярну концентрацію с, а на осі ординат – значення 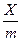 . Постійні К і
. Постійні К і  у рівнянні Фрейндліха визначають, як було вказано, з графіку залежності lg
у рівнянні Фрейндліха визначають, як було вказано, з графіку залежності lg 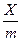 від lg c.
від lg c.
4. ДОСЛІДЖЕННЯ АДСОРБЦІЇ ЗАБАРВЛЕНИХ РЕЧОВИН ІЗ РОЗЧИНІВ
У ряд пробірок помістити по 1 мл розчину з масовою часткою 0,02% метиленової сині, 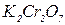 ,
, 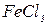 , золю
, золю  , конго червоного, водного розчину фуксину і 1 мл спиртового розчину фуксину. Потім додати в усі пробірки по 0,2 г активованого вугілля, перемішувати про-
, конго червоного, водного розчину фуксину і 1 мл спиртового розчину фуксину. Потім додати в усі пробірки по 0,2 г активованого вугілля, перемішувати про-
тягом 2–3 хв і відфільтрувати. Спостерігати зміну забарвлення та пояснити явище адсорбції.
Результати роботи занести в таблицю:
| Назва розчину | |||||||
| Забарвлення розчину до адсорбції | |||||||
| Забарвлення розчину після адсорбції | |||||||
| Висновок про характер адсорбції |
5. ДОСЛІДЖЕННЯ АДСОРБЦІЇ ІЗОАМІЛОВОГО СПИРТУ ІЗ РОЗЧИНУ ЗА ДОПОМОГОЮ АКТИВОВАНОГО ВУГІЛЛЯ
Для роботи необхідно: 0,1 моль/л розчин ізоамілового спирту; сталагмометр; штатив з пробірками; активоване вугілля.
Поверхневий натяг розчину визначити сталагмометричним мето-
дом, описаним в роботі V.1. Потім помістити 10 мл цього розчину у про-
бірку, додати 0,2 г активованого вугілля і перемішувати протягом 2–3 хв. Відфільтрувати розчин і знову визначити його поверхневий натяг. Пояс-
нити, чому він змінився.
6. ВИЗНАЧЕННЯ ПОВНОЇ ОБМІННОЇ ЄМНОСТІ (ОЄ) КАТІОНІТУ
Для роботи необхідно: 0,1 моль/л NaOH; 0,1 моль/л розчин НСl; мірна колба на 250 мл; катіоніт; індикатор.
Обмінна ємність – це кількість еквівалентів (ммоль) речовини адсор-
бованої 1 г адсорбента. У колбу об’ємом 250 мл помістити 1 г катіоніту, додати 100 мл 0,1 моль/л розчину NaOH, перемішати і залишити на
1 годину. Після цього відібрати піпеткою 25 мл розчину і перенести її в колбу для титрування. До проби додати 1–2 краплі індикатора і відтитрувати 0,1 кмоль/м3 розчином НС1 до зміни забарвлення індикатора. Обмінну ємність вираховують за формулою 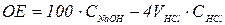 .
.
7. ВИЗНАЧЕННЯ ВМІСТУ ЛІКАРСЬКОЇ РЕЧОВИНИ (ГЛЮКОНАТУ КАЛЬЦІЮ) В РОЗЧИНІ МЕТОДОМ ЙОНООБМІННОЇ АДСОРБЦІЇ
Для роботи необхідно: глюконат кальцію; Н-катіоніт; 0,1 М розчин NaOH; індикатор метиловий оранжевий.
УВАГА! При роботі з колонкою не допускається проникнення повітря в йоніт. Рівень рідини не повинен опускатися нижче верхнього рівня йоніту.
Через колонку з Н-катіонітом повільно пропускають 20 мл дослід-
жуваного розчину, який містить глюконат кальцію. Потім колонку проми-
ти 25 мл дистильованої води, збираючи її в ту ж колбу. Весь зібраний фільтрат відтитрувати 0,1 М розчином NaOH з індикатором метиловим оранжевим. Вміст глюконату кальцію вирахувати за формулою:
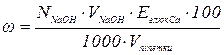 .
.
8. ОБЕЗСОЛЮВАННЯ ВОДИ ЗА ДОПОМОГОЮ ЙОНІТІВ
Для роботи необхідно: Н-катіоніт; ОН-аніоніт; оксалат амонію; нітрат аргентуму; піпетка; штатив з пробірками; метилоранж.
Для обезсолювання води взяти воду з водогону. За допомогою якісних реакцій виявити у воді йони хлору (реакцією з AgNO3) і йони кальцію (реакцією з оксалатом амонію (NH4)2C2O4).
Через колонку з Н-катіонітом пропустити повільно 25 мл води з водогону, потім промити 25 мл дистильованої води. З отриманого розчину відібрати піпеткою по декілька крапель у 2 пробірки. В 1-й перевірити наявність Са2+ (реакція з (NH4)2C2O4), в 2-й – наявність йонів Н+ (ме-
тилоранж). З одержаного попереднього розчину відібрати 25 мл і про-
пустити через колонку з ОН-аніонітом та промити 25 мл дистильованої води. Відібрати в пробірку декілька крапель розчину і перевірити наявність йонів С1–.
9. РОЗДІЛЕННЯ ЙОНІВ Fе3+, Cu2+,Co2+ МЕТОДОМ ХРОМАТОГРАФІЇ НА ОКСИДІ АЛЮМІНІЮ
Для роботи необхідно: А12О3; металевий штатив; розчини CuSO4, FeCl3 i CoCl2.
Колонку з адсорбентом (А12О3) закріпити у штатив і пропустити через неї 1 мл суміші, що складається з рівних об’ємів розчинів CuSO4, FeCl3 i CoCl2 з масовою часткою 0,1. Спостерігати забарвлення розчину. У про-
токолі замалювати шари адсорбенту відповідними кольорами.
VI. РОЗЧИНИ НЕЕЛЕКТРОЛІТІВ
1. ВИЗНАЧЕННЯ КРИТИЧНОЇ ТЕМПЕРАТУРИ
ВЗАЄМНОГО РОЗЧИНЕННЯ РІДИН
Для роботи необхідно: прилад для визначення критичної температу-
ри; плитка електрична; технічні терези; піпетка, градуйована на 5–10 мл; штатив з пробірками; фенол; вода.
У випадку обмеження взаємної розчинності двох рідин у певній області концентрації завжди має місце рівновага між двома розчинами різного складу.
Очевидно, при заміні температури ця рівновага буде змінюватися в ту чи іншу сторону. Всі ці співвідношення можуть бути подані графічно на діаграмах температура – склад.
Температура, вище або нижче якої рідини взаємно розчинні у всіх співвідношеннях, називається критичною температурою розчинення. Роз-
різняють верхню і нижню критичні температури розчинення.
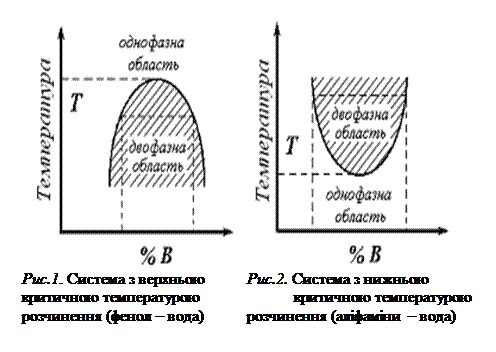 |
Нижче приводяться приклади діаграм температура – склад систем з верхньою і нижньою критичними температурами розчинення (рис. 1, 2, 3).
Криву взаємної розчинності двох рідин найпростіше знайти, визна-
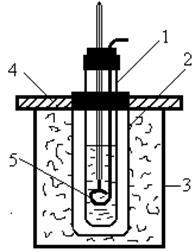
чаючи температуру зникнення або появи другої фази. Для визначення цієї температури зручно використовувати прилад, зображений на рис. 4.
Колба 1 служить водяною або масляною банею, в пробірку 2 помі-
щають досліджувану суміш, в неї на коркові вставляють термометр 3 і мішалку 4.
Виходячи з загальної наважки і процентного вмісту, розраховують ва-
гові кількості для одержання досліджуваних сумішей.
Якщо другими компонентами буде рідина, то її можна брати в об’єм-
них одиницях. Для цього необхідно знати її густину. Густина води при температурі досліду приймається рівною одиниці.
Для дослідження беруть дві речовини, що погано розчиняються одна в одній, наприклад система фенол – вода.
Готують декілька сумішей з різним процентним складом, який вка-
зується керівником занять. Загальна вага суміші не повинна перевищува-
ти 5–6 г.
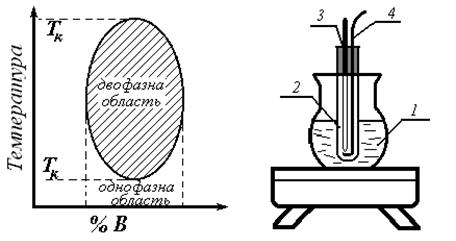
Рис. 3. Система з верхньою і Рис. 4. Схема приладу для
нижньою критичними визначення критичної
температурами розчинення температури розчинення.
(нікотин – вода).
Спочатку зважують необхідну кількість фенолу, потім відмірюють не-
обхідну кількість води для одержання суміші певного процентного складу.
Встановлюють пробірку в прилад для визначення критичної темпера-
тури і відмічають дві температурні точки: температуру гомогенізації (пере-
хід системи в одну фазу) і температуру гетерогенізації (розділення системи на дві фази).
Для одержання точних даних потрібно змінювати температуру повіль-
но, при безперервному перемішуванні суміші в пробірці з метою уник-
нення перегріву, переохолодження.
При роботі з фенолом потрібно слідкувати за тим, щоб він не потра-
пив на шкіру, так як він викликає опіки.
По одержаних даних будують діаграму: температура – склад, по якій визначають критичну температуру розчинення і проводять контрольне визначення процентного складу по температурі взаємного розчинення. Результати дослідів заносять у таблицю:
| №№ пробірок | ||||||||||||
| % фенолу | ||||||||||||
| Наважка фенолу, кг | ||||||||||||
| Наважка води, кг | ||||||||||||
| Температура гомогенізації, К | ||||||||||||
| Температура гетерогенізації, К | ||||||||||||
| Середня температура, К |
2. ВИЗНАЧЕННЯ МОЛЕКУЛЯРНОЇ МАСИ РОЗЧИНЕНОЇ
РЕЧОВИНИ КРІОСКОПІЧНИМ МЕТОДОМ
Для роботи необхідно: кріоскоп; пробірка для розчину з мішалкою; термометр Бекмана; стаканчик фарфоровий; лід; сіль; речовина і розчини для дослідження.
Виходячи з сучасної теорії розведених розчинів, встановлена залеж-
ність пониження точки замерзання 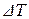 розчинника від концентрації роз-
розчинника від концентрації роз-
чиненої в ньому речовини:
 ,
,
де Ккр – кріоскопічна стала; g – вага розчиненої речовини, кг; gо – вага розчинника, кг; М – молекулярна маса розчиненої речовини. Це рівняння справедливе для розведених розчинів, що не дисоціюють на йони, а також неасоційованих.
Розв’язавши це рівняння відносно молекулярної маси М, експери-
ментально визначаючи величини, що входять до нього, можна розрахувати молекулярну вагу неелектроліту:
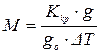 ,
,
де gо – вага розчинника, кг (її можна брати і в об’ємних одиницях, знаючи густину розчинника). Для води густина приблизно дорівнює 1.
Визначаючи експериментально пониження температури замерзання розчину неелектроліту, можна розрахувати його молярність, виходячи з того, що кріоскопічна стала Ккр – молярне пониження точки замерзання розчинника, тобто таке пониження температури, яке спостерігається, коли в 1 кг розчинника розчинений 1 моль речовини.
Молярну концентрацію розчину неелектроліту визначають за фор-
мулою:
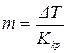 .
.
Значення кріоскопічної сталої залежить від властивостей і виража-
ється рівнянням:
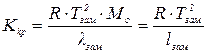 ,
,
де R – газова стала в калоріях; T – абсолютна температура замерзання розчинника; Mo – молекулярна маса розчинника; lзам. – молекулярна теплота замерзання розчинника; lзам. – питома теплота замерзання роз-
чинника.
Температури замерзання деяких розчинників, а також кріоскопічні сталі приведені в табл. 2, що знаходиться в кінці опису.
У випадку слабких електролітів число молекул і йонів у і разів більше числа початково взятих молекул:
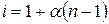 ,
,
де і – коефіцієнт Вант-Гоффа; a – ступінь дисоціації; п – число йонів, які утворюються з однієї молекули. Тому рівняння для пониження темпе-
ратури замерзання у випадку слабких електролітів можна записати в такому вигляді:
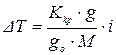 .
.
Для електролітів, молекулярна маса яких невідома, розв’язуючи це рівняння, одержимо:
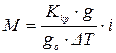 .
.
У випадку слабких електролітів, при відомій молекулярній масі, можна підрахувати коефіцієнт Вант-Гоффа:
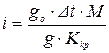 .
.
Знаючи і, підраховують ступінь дисоціації електролітів
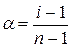 .
.
| Рис.1 |
Прилад для кріоскопічних вимірювань, зображений на рис. 1, складається з таких частин. Пробірка 1 закріплена на коркові в металевому посуді 2, який відіграє роль повітряної сорочки. Стакан 3, в який помі-
щають охолоджуючу суміш, закривається криш-кою 4 з двома отворами, в один з яких вставляють корок для пробірки 1, а в другий – мішалку 5.
Перш ніж приступити до роботи, необ-
хідно ознайомитися з термометром Бекмана (рис. 2.).
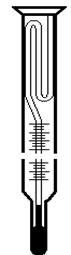 Рис. 2.
Рис. 2.
|
Особливістю цього термометра є велика довжина шкали (приблизно
5 см на 1 К) і наявність у верхній частині термометра запасного резервуара з ртуттю, який дає можливість змінювати кількість ртуті в робочій частині термометра. Велика довжина шкали дозволяє робити від-
ліки з необхідною для вимірів точністю, а запасний резервуар дає можливість встанов-
лювати термометр на різні температурні інтервали.
Шкала термометра розділена на 5 К, кожний градус ділиться на десяті долі, а кожна десята доля в свою чергу ділиться на соті долі; тисячні долі можуть бути при-
близно розраховані за допомогою лупи.
Термометр для кріоскопічних вимірів налагоджується так, щоб при температурі замерзання рівень ртуті знаходився між третім і п’ятим градусами. Перед наладкою термометра перевіряють його покази при умовах, необхідних для роботи. Якщо рівень ртуті в капілярі не буде встановлюватися між 3 К і 5 К, термометр необхідно налагодити. Це робиться наступним чином: затискують рукою нижній резервуар ртуті, тобто нагрівають його і з’єднують із стовпчиком ртуті в верхньому резервуарі. Якщо в нижньому резервуарі був надлишок ртуті, тобто ртуть піднімалась у попередньому досліді вище п’ятого градусу, то після з’єднання обох резервуарів необхідно частину ртуті перевести в верхній резервуар. Для цього термометр повертають верхнім резервуаром вниз. Якщо ртуть у попередньому досліді опускалась нижче нуля, тобто в нижньому резервуарі ртуті недостатньо, то частину ртуті необхідно перелити з верхнього в нижній резервуар.
Для цього з’єднують верхній і нижній резервуар, і нижній резервуар охолоджують в суміші льоду і води. Після того, як ртуть перейде в деякій кількості в потрібному напрямку, розривають стовпчик ртуті в капілярі. Нижній резервуар затискають у долоні і легким постукуванням однієї руки по другій розривають стовпчик ртуті. У випадку, коли ртуть не зупи-
няється в потрібному інтервалі температур, налагодження повторюють.
Налагоджений термометр залишають у стакані з льодом і присту-
пають до наступної операції.
Розчинник наливають у пробірку в такій кількості, щоб після зану-
рення в нього термометра Бекмана рівень рідини був на 2–3 см вищий верх-
ньої частини нижнього резервуару, а нижня частина резервуару не повин-на доходити до дна на 1–2 см. У більшості випадків заливають 25–40 мл розчинника.
Потім готують охолоджену суміш із води, льоду і солі з температурою на 3–4 К нижче температури замерзання розчинника. Заповнюють охо-
лоджуючою сумішшю стакан 3, проводять наближене визначення to замерзання розчинника. Для цього пробірку з розчинником і вставленим в неї термометром поміщають безпосередньо в охолоджуючу суміш. Перемішуючи рідину, спостерігають за показами термометра. Внаслідок переохолодження температура опускається нижче точки замерзання; коли починається кристалізація в результаті виділення теплоти кристалізації, температура розчину починає підвищуватися. По термометру відра-
ховують максимальну температуру, яка й приймається за наближену температуру замерзання. Наближеною вона являється тому, що дослід проводиться в умовах, які не виключають нерівномірностей охолодження.
Після наближеного визначення температури пробірку виймають з охолоджуючої суміші і розплавляють утворені кристали, опускаючи про-
бірку у воду кімнатної температури. Потім ставлять пробірку у повітряну сорочку 2 приладу. Для прискорення процесу охолодження рідину в пробірці 1 перемішують мішалкою 5. Коли встановиться температура приблизно на 0,5 К вище попередньо знайденої наближеної температури кристалізації, перемішування припиняють і переохолоджують рідину на 0,2–0,5 К нижче наближеної температури. Перемішуючи переохолоджений розчинник, зумовлюють його кристалізацію. Процес кристалізації супро-
воджується виділенням прихованої теплоти плавлення, яка, в свою чергу, веде до збільшення температури. Максимальну температуру, яка спосте-
рігалась при кристалізації, відмічають, користуючись лупою з точністю до 0,002 К і записують як температуру замерзання розчинника.
Вимірювання температури замерзання чистого розчинника повто-
рюють декілька разів. Після кожного визначення пробірку 1 виймають з приладу, утворені кристали розплавляють, як було вказано вище.
Середнє арифметичне з окремих вимірів приймають за дійсне зна-
чення температури замерзання розчинника. Графічна похибка не повинна перевищувати 0,005 К.
Для визначення молекулярної маси досліджуваної речовини беруть наважку g 0,2–0,3 г з точністю зважування до 0,0001 г і розчиняють її в даному розчиннику.
Наближену температуру кристалізації визначають так, як і для роз-
чинника.
Визначення проводять 3 рази. Середнє значення трьох вимірів беруть за дійсне.
В даній роботі студент повинен виконати наступні завдання:
1. Визначити молекулярну масу речовини.
2. Визначити ступінь дисоціації слабкого електроліту або коефіцієнт активності сильного електроліту.
3. Визначити молярну концентрацію розчину неелектроліту.
Результати роботи і розрахункові дані записують по формі:
Об’єм розчинника V =
Вага розчинника go =
Вага розчиненої речовини g =
Електроліт для визначення ступені дисоціації
Об’єм, взятий для досліджування молярної концентрації Vk =
Вага розчинника go =
Вага розчиненої речовини g =
Досліджувані і розрахункові дані заносяться в табл. 1.
Таблиця 1
| Температура кристалізації, К | Середня температура кристалізації, К | Пониження температури кристалізації, К | Результати | |
| Чистий розчинник | ||||
| Розчин для ви- значення моле- кулярної маси | ||||
| Розчин для ви- значення молекулярної концентрації | ||||
| Розчин для ви- значення ступені дисоціації |
Таблиця 2
| Розчинник | Тзам., К | Обрахована Ккр | Експери- ментально визначена Ккр |
| Вода | 273,2 | 1,862 | 1,86 |
| Нітробензол | 278,8 | 6,83 | 6,90 |
| Бензен | 278,9 | 5,12 | 5,10 |
| Фенол | 313,2 | 7,80 | 7,80 |
| Камфора | 451,2 | 48,20 | 49,00 |
VII. РОЗЧИНИ ЕЛЕКТРОЛІТІВ
1. ВИЗНАЧЕННЯ ЕЛЕКТРОПРОВІДНОСТІ ЕЛЕКТРОЛІТІВ І ОБЧИСЛЕННЯ СТУПЕНЯ ДИСОЦІАЦІЇ
Для роботи необхідно: реохорд АВС; звуковий генератор ЗГ; на-
вушники Т або осцилограф; посуд для визначення електропровідності і платинові електроди Б; мірна колба на 50–100 мл; піпетки мірні; колбочки мірні; розчини електролітів; магазин опору.
Так як електропровідність є величиною обернено пропорційною опо-
рові, то визначення її зводиться до вимірювання опору. Електрична схема, за якою проводиться вимірювання опору, подана на рис. 1.
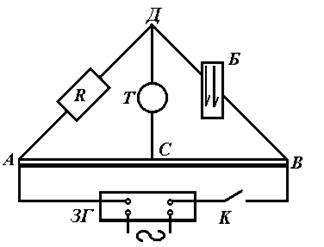
Рис. 1. Електрична схема для визначення
електропровідності (мостик Кольрауша).
Від джерела струм поступає в А, розгалужується, іде по АВС і АДС. Переміщаючи контакт С по дротині АВ, можна знайти таке положення, при якому на відрізку ДС струму не буде. Це має місце, коли
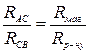 ,
,
звідки
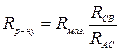 .
.
При визначенні електропровідності користуються слабкими стру-
мами високої частоти. Як джерело струму використовують звуковий генератор; як нуль-інструмент використовують навушники або осци-лограф. Точка рівноваги визначається таким положенням контакту С, при якому в навушниках зовсім не чути звуку, або він є мінімальним, або на екрані осцилографу чітка яскрава точка.
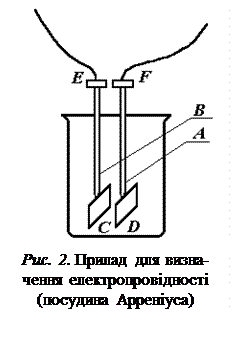 Прилад для визначення електропровід-ності зображений на рис. 2. Це скляна посу-
Прилад для визначення електропровід-ності зображений на рис. 2. Це скляна посу-
дина з опущеними в неї трубками А і В.
До нижніх кінців трубок впаяні плати-
нові електроди С і D. Щоб запобігти поля-
ризації, поряд із застосуванням слабких змін-
них струмів високої частоти збільшують по-
верхню електродів. З цією метою електроди платинуються.
Date: 2015-09-24; view: 705; Нарушение авторских прав