
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типовые задачи. Задача 1. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г белков
|
|
Задача 1. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г белков, 57,1 г углеводов и 1,2 г жиров. Коэффициенты калорийности брать по нижней границе.
Решение
1. Найти массы белков (mб), углеводов (mу) и жиров (mж) в 450 г хлеба «Бородинский»:
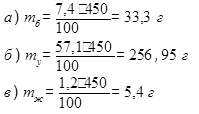 |
2. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г:
К = (mб ·16,5 + mу · 16,5 + mж · 37,7) кДж
К = 33,3 · 16,5 + 256,95 · 16,5 + 5,4 · 37,7 = 4992,705 кДж
Ответ: К = 4992,705 кДж.
Задача 2. Определить изменение энтальпии химической реакции:
2С2Н5ОН(ж) → С2Н5-О-С2Н5(ж) + Н2О(ж), используя следующие данные:
DН0сгор С2Н5ОН(ж) = –1370,00 кДж·моль-1
DН0сгор С2Н5ОС2Н(ж) = –2720,04 кДж·моль-1
DН0сгор Н2О(ж) = 0 кДж·моль-1
Решение:
Поскольку даны энтальпии сгорания реагентов и продуктов, то используя 2-ое следствие из закона Гесса запишем:
DН0р-я = SDН0сгор. реагентов – SDН0сгор. продуктов
Применительно к этой реакции:
DН0р-я = 2DН0сгорС2Н5ОН(ж) – DН0сгорС2Н5ОС2Н5(ж) = 2 · (–1370,00) – (–2720,04) =
-2740,00 + 2720,04 = –19,96 кДж·моль-1.
Ответ: DН0р-я = –19,96 кДж·моль-1.
Задача 3. Определить стандартную энтальпию образования оксида меди (II) CuO(к), используя следующие данные:
1) 3CuO(к) + 2NH3(г) = 3Cu(к) + N2(г) + 3H2O(ж), DH10 = –299,53 кДж·моль-1
2) 1/2N2(г) + 3/2H2(г) = NH3(г), DH20 = –46,19 кДж·моль-1
3) H2(г) + 1/2О2(г) = H2О(ж), DH30 = –285,838 кДж·моль-1
Решение:
Поскольку необходимо определить стандартную энтальпию образования оксида меди (II), то используя I-ое следствие из закона Гесса запишем:
DН0р-я = SDН0обр. продуктов – SDН0обр. реагентов
Применительно к 1-ой реакции:
DН0р-я = 3DН0обрCu(к) + DН0обрN2(г) + 3DН0обрН2О(ж) – (3DН0обрCuО(к) – 2DН0обрNH3(г)).
Учитывая, что в термохимии энтальпии образования простых веществ азота N2(г) и меди Cu(к) приняты равными нулю и раскрыв скобки, получаем следующее уравнение:
DН0р-я = 3DН0обрН2О(ж) – 3DН0обрCuО(к) – 2DН0обрNH3(г).
Переносим в левую часть уравнения DН0обрCuО(к) с обратным знаком и получаем:
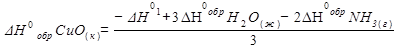 |
 |
Подставим числовые значения указанных параметров:
Ответ: DН0обр CuО(к) = - 155,20 кДж·моль-1.
Задача 4. Рассчитать величину стандартного изобарно-изотермического потенциала для следующей реакции: 2C4H10(г) + 5О2(г) → 4CH3COOH(ж) + 2Н2О(ж), используя следующие данные:
DН0р-я = –2267,94 кДж·моль-1
DS0р-я = –866,30 Дж·моль-1
Решение:
Поскольку даны значения энтальпийного и энтропийного факторов, то для расчета стандартного изобарно-изотермического потенциала используем следующее уравнение:
DG0р-я = DН0 – Т·DS0
Прежде, чем подставить в это уравнение значения указанных параметров, необходимо перевести величину энтропийного фактора в кДж·моль-1. Это будет составлять –0,866 кДж·моль-1.
Подставляем цифровые значения указанных величин в приведенное уравнение. При этом учитываем, что стандартная температура составляет 298 К:
DG0р-я= –2267,94 – 298 · (–0,866) = –2009,782 кДж·моль-1
Ответ: DG0р-я= –2009,782 кДж·моль-1
Date: 2015-09-22; view: 2194; Нарушение авторских прав