
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Работа №5: Качественное определение галогенов
в органических соединениях (проба Бейльштейна)
При сгорании органического галогенсодержащего вещества в присутствии CuO образуются галогениды меди, окрашивающие пламя в ярко-зеленый цвет (проба Бейльштейна). Реакция высокочувствительна. Она используется для качественного обнаружения галогенов при проверке подлинности лекарственных веществ.
1.Обнаружение хлора в хлороформе
Для проведения опыта используется медная проволока, закрепленная одним концом в пробке, на другом конце проволоки делается небольшая петля. Сначала, удерживая за пробку, прокалите другой конец проволоки в пламени спиртовки до прекращения окрашивания пламени и появления на проволоке черного налета CuO. Затем после охлаждения смочите кончик проволоки в хлороформе и введите в пламя спиртовки: сначала пламя становится желтым (сгорает углерод), а затем появляется интенсивное зеленое окрашивание.
2. Обнаружение хлора в других органических веществах
По выше приведенной методике определите наличие галогена в четырех органических веществах (образцы №№ 1,2,3,4)
По окончании работы составьте отчет и сдайте на проверку преподавателю.
Содержание отчета:
I. Название работы.
II. Ход работы.
III. Результаты опытов:
Отметить наличие или отсутствие галогена в образцах №№ 1,2,3,4.
Результаты проверить у преподавателя.
IV. Отметить практическое значение пробы Бейльштейна.
ЛИТЕРАТУРА:
Руководство к лабораторным занятиям по органической химии под ред. Н.А.Тюкавкиной – ДРОФА, М., 2003, с. 244.
Работа №6: Идентификация одно- и двухатомных спиртов и фенолов
1.Окисление этанола
В пробирку поместите 1 мл 10%-ной серной кислоты, 1 мл раствора бихромата калия и 0,5 мл этилового спирта. Обратите внимание на желто-оранжевый цвет смеси. Затем нагрейте пробирку на спиртовке до тех пор, пока цвет раствора не станет сине-зеленым. Одновременно появляется запах уксусного альдегида, напоминающий запах гниющих яблок.
2. Взаимодействие спиртов с Cu(OH)2 в щелочной среде
В пробирку поместите 2-4 мл раствора NaOH и 0,5 мл раствора CuSO4. Выпадает синий творожистый осадокCu(OH)2. Содержимое пробирки разделите на пополам (пробирки №1 и №2). В пробирку №1 добавьте 1,0 мл этанола, а в пробирку №2 – 1,0 мл глицерина, перемешайте, запишите ваши наблюдения.
3. Цветная реакция резорцина с FeCl3
В пробирку поместите 1 мл раствора резорцина и 1 каплю раствора FeCl3. Появляется интенсивная синяя окраска (при необходимости разбавьте содержимое пробирки водой).
По окончании работы составьте отчет и сдайте на проверку преподавателю.
Содержание отчета:
I. Название работы.
II. Ход работы.
III. Ответьте на следующие вопросы:
1. Почему при нагревании смеси "спирт - бихромат калия - серная кислота" окраска из оранжевой переходит в зеленую? Напишите схему этой реакции.
2. Почему при добавлении глицерина осадок Cu(OH)2 растворяется и происходит углубление цвета? Напишите схему этой реакции. Каково её практическое применение? Почему с этанолом подобной реакции не происходит?
3. С чем связано появление сине-фиолетового окрашивания при добавлении FeCl3 к раствору резорцина? Напишите схему этой реакции. Каково её практическое применение?
ЛИТЕРАТУРА:
Руководство к лабораторным занятиям по органической химии под ред. Н.А.Тюкавкиной – ДРОФА, М., 2003, с. 251, 252, 258.
Работа №7: Качественные реакции на альдегиды и кетоны
1. Окисление ацетальдегида реактивом Фелинга
Возьмите две пробирки и в каждую из них поместите по 1 мл реактива Фелинга (комплекс Cu(2+) с солью винной кислоты). В первую пробирку добавьте 1 мл раствора ацетальдегида, во вторую – 1 мл ацетона. В обеих пробирках верхнюю часть жидкости (у мениска) осторожно нагревайте на спиртовке несколько секунд и наблюдайте изменение цвета осадка.
2. Иодоформная реакция ацетона
В пробирку поместите 3-4 капли раствора иода в иодиде калия и прибавьте по каплям
10%-ный раствор NaOH до почти полного обесцвечивания. К полученному раствору добавьте 1-2 капли ацетона – отметьте выпадение желтовато-белого осадка с характерным запахом.
По окончании работы составьте отчет и сдайте на проверку преподавателю.
Содержание отчета:
I. Название работы.
II. Ход работы.
III. Ответьте на следующие вопросы:
Опыт 1. Как меняется окраска в пробирках 1 и 2? Что это означает? Напишите схему реакции ацетальдегида с реактивом Фелинга. Возможна ли подобная реакция с ацетоном?
Опыт 2. Напишите схему иодоформной реакции ацетона? Каково практическое значение этой реакции?
ЛИТЕРАТУРА:
Руководство к лабораторным занятиям по органической химии под ред. Н.А.Тюкавкиной – ДРОФА, М., 2003, с. 269, 271.
Работа №8: Химические свойства карбоновых кислот
1. Обнаружение щавелевой кислоты
В пробирку поместите лопаточку щавелевой кислоты и 3-4 капли воды, перемешайте до полного растворения. Добавьте в пробирку 2-3 капили 5%-ного раствора CaCl2. Отметьте появление белого осадка оксалата кальция.
2. Получение сложных эфиров
Возьмите две сухие пробирки. В каждую из них поместите 3 лопаточки безводного ацетата натрия (или 1 мл ледяной уксусной кислоты) и 3 капли концентрированной серной кислоты. В первую пробирку добавьте 3 капли этанола, во вторую – 3 капли бутанола. Обе пробирке нагревайте на кипящей водяной бане в течение 5 минут. Затем в обе пробирки налейте по 1-2 мл воды. Жидкость в пробирках разделяется на два слоя: нижний – раствор неорганических солей и не прореагировавших исходных веществ, верхний – образовавшийся продукт – сложный эфир. Отметьте характерный фруктовый запах сложных эфиров.
По окончании работы составьте отчет и сдайте на проверку преподавателю.
Содержание отчета:
I. Название работы.
II. Ход работы.
III. Ответьте на следующие вопросы:
1. Напишите схему реакции щавелевой кислоты с CaCl2. Щавелевая кислота применяется в медицине для биохимического анализа мочи. Какой компонент мочи можно определить с её помощью?
2. Напишите схему реакции уксусной кислоты с этанолом. Как называются реакции такого типа? К какому классу соединений относятся продукты таких реакций? Приведите механизм реакции и объясните, какую роль играет здесь серная кислота,
ЛИТЕРАТУРА:
Руководство к лабораторным занятиям по органической химии под ред. Н.А.Тюкавкиной – ДРОФА, М., 2003, с. 277, 279.
Работа №9: Химические свойства мочевины
1. Основные свойства мочевины
Мочевина реагирует с азотной кислотой с образование трудно растворимого нитрата:
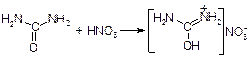
В пробирку помещают 1 лопаточку кристаллической мочевины и 2-3 капли воды. К полученному раствору добавляют 2 капли концентрированной азотной кислоты. Через несколько секунд начинается выделение кристаллов нитрата мочевины.
2. Термическое разложение мочевины
Мочевина при нагревании выше температуры плавления дает биурет (А), который с Cu(OH)2 образует комплекс (В):

В сухую пробирку помещают 1 лопаточку кристаллической мочевины и осторожно нагревают. Наблюдается плавление вещества и выделение пузырьков газа. (Поднесите к отверстию пробирки индикаторную бумажку и отметьте изменение её цвета.) Пробирку нагревают до тех пор, пока расплав не затвердеет. Затем охлаждают, добавляют 1-2 мл воды и кипятят 1 мин. Жидкость декантируют в другую пробирку, добавляют к ней 1 мл раствора NaOH и 1 каплю раствора CuSO4. Отмечают окраску образующегося биуретового комплекса.
По окончании работы составьте отчет и сдайте на проверку преподавателю.
Содержание отчета:
I. Название работы.
II. Ход работы.
III.Выводы:
Отметьте: 1) Напишите схемы химических реакций. 3) Какие химические свойства мочевины демонстрируют проведенные реакции?
Date: 2015-09-22; view: 1083; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |