
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема 10: Спирты, фенолы, простые эфиры
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ ТЕМЫ:
I. Спирты.
1. Классификация, номенклатура и изомерия одно- и многоатомных спиртов. Их физические свойства.
2. Способы получения спиртов: гидратация алкенов, гидролиз галогенопроизводных, восстановление карбонильных соединений, Mg-органический синтез, брожение.
3. Химические свойства.
3.1. Кислотно-основные свойства: образование алкоголятов и оксониевых солей.
3.2. Нуклеофильные свойства спиртов: образование простых и сложных эфиров.
О-алкилирование – синтез Вильямсона; О-ацилирование, алкилсульфаты – алкилирующие агенты, алкилнитраты (нитроглицерин, нитросорбид).
3.3. Реакции нуклеофильного замещения гидроксильной группы – образование алкилгалогенидов.
3.4. Реакции элиминирования – образование алкенов.
3.5. Окисление первичных и вторичных спиртов – образование альдегидов и кетонов.
4. Многоатомные спирты: диолы (гликоли), триолы (глицерины), эритриты, пентиты, гекситы. Способы получения и особенности химических свойств многоатомных спиртов: повышенная кислотность ОН-групп, образование комплексов с Cu2+. Природные многоатомные спирты – сорбит, ксилит, инозит.
5. Непредельные спирты – виниловый (правило Эльтекова), аллиловый.
II. Фенолы.
1. Классификация, номенклатура и физические свойства фенолов.
2. Способы синтеза фенола: щелочное плавление сульфокислот, замещение хлора в хлорбензоле, из солей диазония, окисление изопропилбензола (способ Сергеева).
3. Химические свойства.
3.1. Кислотные свойства фенолов, образование солей и комплексов с металлами. Качественные реакции обнаружения фенолов.
3.2. Нуклеофильные свойства: получение простых и сложных эфиров. Анизол, фенетол, аспирин (ацетилсалициловая кислота), фенилсалицилат (салол).
3.3. Реакции электрофильного замещения в ароматическом ядре фенолов и нафтолов: галогенирование, нитрование, сульфирование, карбоксилирование, гидроксиметилирование. Фенолфталеин, пикриновая кислота.
3.4. Окисление фенолов. Образование хинонов. Хингидрон. Роль системы гидрохинон-хинон в биологических процессах.
4. Многоатомные фенолы – гидрохинон, резорцин, пирогаллол – их восстановительные и антиоксидантные свойства. Природные полифенолы – антиоксиданты: токоферол (витамин Е), рутин – (витамин Р), антоцианины.
III. Простые эфиры.
1. Общая характеристика простых эфиров– номенклатура, изомерия, физические свойства.
2. Методы получения простых эфиров: синтез Вильямсона, дегидратация спиртов, присоединение спиртов к алкенам и алкинам.
3. Химические свойства.
3.1. Основные свойства – образование оксониевых солей с минеральными кислотами и кислотами Льюиса. Образование комплексов со щелочными металлами – краун-эфиры.
3.2. Расщепление при действии с HI.
3.3. Окисление кислородом, образование α-гидроперекисей.
4. Циклические эфиры. Тетрагидрофуран, диоксан – апротонные полярные растворители.
Оксираны (окиси алкенов, 1,2-эпоксиды) – методы их получения, реакции с раскрытием цикла.
ПИСЬМЕННОЕ ДОМАШНЕЕ ЗАДАНИЕ:
1. Дополните схему следующих превращений, дайте названия соединений А, В, С и D. Приведите схемы механизмов реакций В→А и C→D.

2. Приведите условия и схемы реакций получения из непредельных углеводородов:
а) этанола; б) этандиола-1,2.
3. Сравните кислотные свойства этанола (I), этиленгликоля (II), глицерина (III). Напишите реакции их взаимодействия 1) с NaOH, 2) с Na (мет.), 3) с Cu(OH)2. Объясните причину различной кислотности этих соединений.
4. Более 200 лет назад шведский аптекарь К.Шееле, нагревая оливковое масло с PbO, получил вещество, до сих пор широко применяемое в фармации. Это было вещество С. Дополните приведенную ниже схему, лежащую в основе современных методов получения этого вещества:

5. Составьте следующие схемы реакций:

6. Раствор фенола с FeCl3 образует устойчивый комплекс с фиолетовой окраской (качественная реакция на фенолы). Гидрохинон в этих же условиях сначала дает фиолетовую окраску, которая быстро переходит в бурую. Дайте объяснение этому явлению, напишите схемы реакций фенола и гидрохинона с FeCl3.
7. Определите путь следующего превращения:
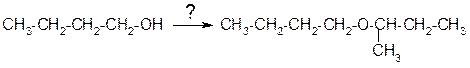
ПРАКТИЧЕСКАЯ ЧАСТЬ:
Лабораторная работа №6. Идентификация одно- и двухатомных спиртов и фенолов.
ЛИТЕРАТУРА ДЛЯ ПОДГОТОВКИ:
Основная:
1. Лекция по органической химии “Спирты и фенолы”.
2. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – Дрофа, М., 2003 г., c.340-363, 390-419.
3. Под ред. Тюкавкиной Н.А. Руководство к лабораторным занятиям по биоорганической химии – М. Медицина, 1985 г., с. 246-250, 260-263.
Дополнительная:
1. Грандберг И.И. – Органическая химия – Дрофа, М., 2002 г., с. 278-310.
Date: 2015-09-22; view: 708; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |