
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема 1. ДНК хромосом
|
|
Вся информация о строении и функционировании любого живого организма содержится в закодированном виде в его генетическом материале, основу которого составляет дезоксирибонуклеиновая кислота (ДНК).
1.1. История исследования ДНК
Ко времени открытия структуры ДНК история изучения нуклеиновых кислот насчитывала уже около восьмидесяти лет. Честь их открытия принадлежит швейцарскому биохимику Фридриху Мишеру, который в 1868—1872 гг. выделил из ядер клеток гноя и спермы лосося новое фосфорсодержащее вещество, названное им нуклеином (от греч.— ядро). Примерно в те же годы Мендель старался убедить ученый мир в значении своей работы. До середины XX столетия никто не предполагал, что эти два открытия столь тесно связаны между собой. Работа Менделя пребывала в забвении до 1901 г., а результаты исследований Мишера в подробном изложении были опубликованы после его смерти — в 1890 г. Незадолго до этого, в 1889 г., немецкий химик Р. Альтман впервые получил свободный от белков нуклеин Мишера и предложил назвать его нуклеиновой кислотой.
К этому времени А. Коссель выделил основные составные части нуклеина: содержащие азот вещества — аденин и гуанин, фосфорную кислоту и соединения из группы углеводов. Впоследствии удалось установить, что в природе существует два типа нуклеиновых кислот ДНК и РНК (у последней сахар— дезоксирибоза — заменен на рибозу, а одно из четырех азотистых оснований — тимин — на урацил). Так как ДНК выделяли в основном из тимуса теленка, а РНК — из дрожжей и растений, то долгое время бытовало представление о том, что ядра клеток животных содержат только ДНК, а ядра клеток растений — только РНК. Только к середине 30-х годов было доказано, что ДНК и РНК содержатся в каждой живой клетке. С развитием методов цитохимии и гистохимии, а также методов фракционирования субклеточных структур к концу 40-х годов было установлено, что ДНК локализуется преимущественно в ядре, а РНК в цитоплазме клеток.
К началу 50-х годов были установлены основные принципы химического строения нуклеиновых кислот. Была выяснена структура их мономеров — нуклеозидов и нуклеотидов, и доказано, что и в ДНК, и в РНК нуклеотидные остатки связаны только 3' — 5'-фосфодиэфирной связью.
До 40-х годов исследование нуклеиновых кислот считалось весьма скучным и вообще бесперспективным занятием. Так продолжалось до 1944 г., когда Эйвери, Мак-Леод и Мак-Карти установили, что дезоксирибонуклеиновая кислота является носителем генетической информации. Это выдающееся открытие, приведшее к установлению химической природы генов. Его история ведет свое начало с 1928 г., когда Фред Гриффит провел эксперименты с заражением мышей пневмококками. Пневмококки вызывают пневмонию у человека и других чувствительных к ним млекопитающих. Они обычно окружены слизистой блестящей оболочкой — полисахаридной капсулой. Этот наружный слой имеет существенное значение для проявления патогенности бактерий. Мутанты, лишенные полисахаридной оболочки, не патогенны. Патогенные бактерии дикого типа обозначают буквой S (от англ. smooth — гладкий), так как они образуют гладкие колонии, а мутантные бактерии, не имеющие капсулы, — буквой R (от англ. rought — шероховатый), так как они образуют шероховатые колонии.
Гриффит обнаружил, что непатогенный мутант можно трансформировать в патогенную S-форму следующим образом. Он инъецировал мышам смесь живых бактерий R-формы и убитых нагреванием пневмококков S. При этом были получены поразительные результаты. Оказалось, что указанная смесь вызывала гибель мышей, хотя ни живые пневмококки, ни убитые нагреванием пневмококки, инъецированные порознь, смерти мышей не вызывали. В крови погибших мышей содержались живые S пневмококки. Следовательно, убитые нагреванием пневмококки каким-то образом трансформировали живые R- и живые S-пневмококки. Это изменение стабильно наследовалось: трансформированные пневмококки давали патогенное потомство S-формы.
Впоследствии R-S-трансформацию удалось воспроизвести в бесклеточной системе (in vitro). Некоторые R-клетки в растущей культуре трансформировались в S-форму при добавлении бесклеточного экстракта убитых нагреванием пневмококков. Это открытие позволило установить химическую природу трансформирующего фактора.
Эйвери с сотр. в своих классических исследованиях показали, что трансформирующий фактор - это дезоксирибонуклеиновая кислота. Новое доказательство трансформирующей активности ДНК было получено несколько позже, когда удалось очистить фермент дезоксирибонуклеазу, разрушающую ДНК. Было показано, что добавление этого фермента необратимо инактивирует трансформирующий фактор.
Публикация выводов Эйвери с сотр. в 1944 г. была встречена с большим удивлением и недоверием, так как едва ли кто-либо ранее придавал ДНК информационную роль. Вездесущему присутствию ДНК в хромосомах большей частью приписывали чисто физиологическую или структурную роль. В то же время считали, что именно хромосомный белок придает генам информационную роль, поскольку еще в начале XX в. были выявлены различия в специфичности белков у различных организмов. Авторы понимали трудность обоснования генетической роли ДНК и в заключительной части своей работы высказали следующее утверждение: «Если результаты представленного исследования о природе трансформирующего начала подтвердятся, то придется признать, что нуклеиновые кислоты обладают биологической специфичностью, химическая основа которой еще не установлена».
В 1952 г. Альфред Херши и Марта Чейз доказали генетическую роль ДНК в совершенно иной системе — при изучении вируса (бактериофага), заражающего бактерию Е. соli. Когда фаги добавляют к бактериальной культуре, они адсорбируются на наружной поверхности бактерии и вводят в нее определенное вещество, в результате чего примерно через 30 мин бактерия разрывается (лизирует), высвобождая большое число новых фаговых частиц — потомков, адсорбированных фагов.
Эксперимент был поставлен следующим образом. Бактерии инфицировали фагом Т2, у которого радиоактивным изотопом метили либо ДНК-компоненты (изотопом фосфора — 32Р), либо белковые компоненты (изотопом серы — 35S). Фаги смешивали с бактериями и неадсорбированные частицы удаляли центрифугированием. Затем инфицированные бактерии энергично встряхивали и разделяли полученный препарат на две фракции путем центрифугирования. Одна фракция содержала пустые фаговые оболочки, отделившиеся от клеточной стенки бактерий, другая — сами бактерии. Анализ фракций показал, что 35 метка была связана с оболочками фага. Большая же часть метки 32Р оказалась внутри инфицированных бактерий. В потомстве фага после инфицирования было найдено примерно 30% исходной метки 32Р. А от исходного белка в фаговом потомстве обнаружили лишь менее 1%. Этот эксперимент прямо показывает, что родительская фаговая ДНК проникает в бактерию и затем становится частью фагового потомства. Именно так должно происходить наследование генетического материала.
Эксперименты Херши и Чейз убедительно подтвердили факты, открытые восемью годами раньше Эйвери с сотр. на другой системе, и результаты работы были сразу восприняты как доказательство генетической роли ДНК.
До 1950 г. доминировала тетрануклеотидная теория структуры ДНК, рассматривающая полинуклеотид как монотонную макромолекулу, состоящую из многократно повторяющихся наборов четырех нуклеотидов. Такая молекула, очевидно, не способна выполнять роль носителя генетической информации. В 1948 г. Хочкисс и Эрвин Чаргафф применили тогда еще новый метод хроматографии на бумаге для разделения и количественной оценки компонентов нуклеиновой кислоты. Этот метод давал возможность проводить более точный анализ нуклеотидных оснований, высвобождающихся при полном гидролизе ДНК. Анализы показали, что в противоположность требованиям тетрануклеотидной теории четыре азотистых основания не обязательно присутствуют в ДНК в точно равных соотношениях. Чаргафф проанализировал образцы ДНК, выделенной из разных организмов, и показал, что молярные соотношения оснований в молекуле ДНК могут варьировать в широких пределах в зависимости от ее биологического источника. Но если она не монотонна, то тогда вполне возможно, что именно состав ее оснований и обусловливает ее биологическую специфичность.
К 1952 г. удалось сформулировать теорию, объясняющую, каким образом ДНК может осуществлять перенос генетической информации в опытах с трансформацией. Основное положение этой теории сводилось к следующему: если молекула ДНК содержит генетическую информацию, то последняя определяется не чем иным, как специфической нуклеотидной последовательностью четырех нуклеотидных оснований в полинуклеотидной цепи.
В 1953 г. Джеймс Уотсон и Френсис Крик установили трехмерную (вторичную) структуру ДНК и сразу же предложили механизм ее репликации (удвоения). Это блестящее достижение стоит в ряду важнейших событий в истории биологии, так как оно открыло путь к пониманию функции гена на молекулярном уровне. Не случайно 1953 год считают годом рождения молекулярной биологии.
Две группы фактов легли в основу модели ДНК. Первая связана с успешным использованием рентгеноструктурного анализа для изучения биологических макромолекул. Одним из первых исследователей, высказавших соображения о трехмерной структуре ДНК, был Астбюри (именно он ввел в 1940 г. термин «молекулярная биология»), который предположил, что полимер ДНК представляет собой стопку уложенных один над другим нуклеотидов. Его измерения показали также, что нуклеотидные остатки, ориентированные перпендикулярно длинной оси молекулы, располагаются вдоль оси через каждые 3,4 Å (1 ангстрем = 10-10 м). Группа исследователей, продолжившая рентгеноструктурные исследования ДНК, начатые Астбюри, и работавшая под руководством Уилкинса, достигла важного методического решения: им удалось приготовить высокоориентированные нити ДНК, на основе которых получили рентгенограмму, показывающую множество ранее не проявлявшихся деталей.
Уотсон и Крик к тому времени рассмотрели несколько возможных вариантов структуры ДНК, однако из-за плохого качества рентгенограмм им не удалось прийти к каким-либо определенным выводам. Рентгенограмма, полученная Розалиной Франклин, сотрудницей Уилкинса, помогла узнать недостающие детали, и в течение нескольких недель вопрос о структуре ДНК был решен.
Определяющую роль в установлении структуры ДНК сыграли факты, полученные Чаргаффом при анализе нуклеотидного состава ДНК различных организмов. В его докладе, сделанном в 1950 г., можно найти следующее утверждение: «Полученные результаты служат опровержением тетрануклеотидной гипотезы. Следует, однако, отметить — хотя трудно еще сказать, не является ли это чистой случайностью,— что во всех изученных до сих пор дезоксирибонуклеиновых кислотах молярные отношения пуринов к пиримидинам в целом, а также аденина к тимину и гуанина к цитозину близки к 1. В этом утверждении впервые была сформулирована важная структурная особенность ДНК, подтвержденная последующими анализами: несмотря на довольно широкое разнообразие в составе (у бактерий молярная доза Г + Ц варьирует от 26 до 74%), проявляемое различными типами ДНК, молярное содержание тимина равно молярному содержанию аденина, так же как содержание гуанина равно содержанию цитозина.
В апреле 1953 г. Уотсон и Крик опубликовали небольшую статью, в которой постулировали структуры ДНК. В том же выпуске Уилкинс с сотр. опубликовали данные рентгеноструктурного анализа, подтверждающие правильность предложенной модели.
1.2. Биологические свойства ДНК
ДНК – полимерная макромолекула, состоящая из тысяч мономеров и имеющая большую молекулярную массу (6х106-6х1012 Да). Мономерами являются нуклеотиды. Участки дезоксирибонуклеиновой кислоты имеют специфическую последовательность нуклеотидов, которая кодирует последовательность аминокислот в полипептидах и рибонуклеотидов в РНК.
Молекула ДНК имет ряд уникальных свойств:
1. Она способна удваиваться во время S-периода интерфазы. Этот процесс называется репликацией. В процессе митоза копии ДНК равномерно распределяются между дочерними клетками.
2. ДНК служит матрицей для образования своих информационных копий в виде РНК. Этот процесс называется транскрипцией. Копия ДНК в виде РНК непосредственно принимает участие в синтезе белков.
3. В случае повреждения ДНК способна к восстановлению структуры, благодаря чему поддерживается консервативность генетической информации. Этот процесс называется репарацией.
Все три вышеназванные процессы происходят с участием ферментов.
4. ДНК способна к мутации – изменению последовательности нуклеотидов.
1.3. Химический состав молекулы ДНК
В состав мономерной единицы ДНК- нуклеотида входит:
· азотистое основание
· моносахарид
· один фосфатный остаток

Азотистые основания представляют собой производные одного из двух соединений – пурина или пиримидина. Пуриновыми производными в ДНК являются аденин (А) и гуанин (G), а пиримидиновыми – цитозин (С) и тимин (Т). Азотистое основание присоединяется к моносахариду с помощью b-N-гликозидной связи, соединяющей С1′-атом моносахарида с N1-атомом пиримидинового производного или N9-атомом пуринового (рис.1.1).
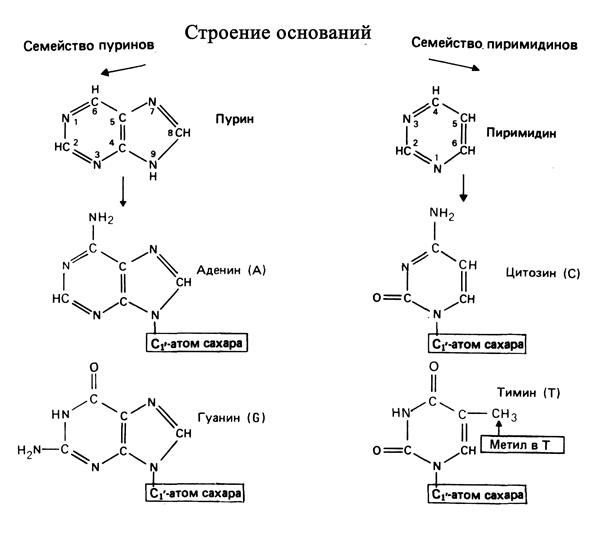
Рис. 1.1. Строение азотистых оснований молекулы ДНК
Моносахарид, входящий в состав нуклеотида – это пентоза в форме b-D-2-дезоксирибозы (рис.1.2).
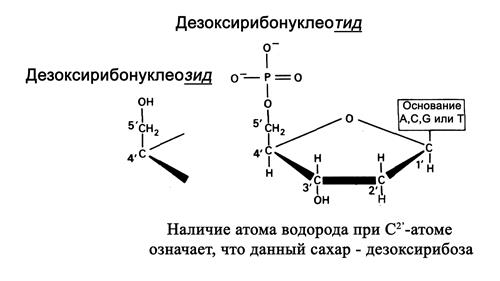
Рис.1.2. Строение сахара в ДНК
В дезоксирибозе в отличии от рибозы гидроксильная (-ОН) группа при 2′-углеродном атоме пентозы замещена на атом водорода.
Азотистое основание, связанное с пентозой, называется нуклеозидом: для ДНК это,соответственно, дезокси аденозин, дезокси гуанозин, дезокси цитидин и дезокси тимидин.
Исходя из этого, составляются и названия нуклеотидов ДНК:
дАМФ- д езокси а денозин м оно ф осфат
дГМФ- д езокси г уанозин м оно ф осфат
дЦМФ- д езокси ц итидин м оно ф осфат
дТМФ – д езокси т имидин м оно ф осфат
1.4. Структура ДНК

Подобно белкам, ДНК имеет первичную, вторичную и третичную структуры.
Каждая из полинуклеотидных цепей ДНК построена из ковалентно связанных дезоксирибонуклеотидных звеньев (рис.1.3). Причем отдельные нуклеодиты в цепи соединяются между собой с помощью фосфодиэфирных мостиков, связывающих 5′ -гидроксильную группу пентозы одного нуклеотида и 3′-гидроксильную группу пентозы следующего. В результате образуется регулярная основная цепь фосфат-сахар-фосфат-сахар – и т.д. (сахарофосфатный остов). При этом азотисные основания как бы «выступают» из сахарофосфатного остова.
Порядок следования оснований вдоль цепи называется первичной структурой ДНК.
Полинуклеотидная цепь обладает полярностью. Концевой нуклеотид на одном конце цепи имеет свободную (не участвующую в образовании межнуклеотидной связи) 5′-группу, на другом конце 3′-группу. Согласно принятому соглашению, последовательность нуклеотидов читается в направлении от 5′ - к 3′- углеродному атому пентозы, т.е. от 5′ - к 3′-концу цепи.
Вторичная структура ДНК представляет собой свернутые в спираль две комплементарно взаимодействующие и антипараллельные полинуклеотидные цепи (рис.1.4). Образование вторичной структуры ДНК возможно вследствие проявления эффектов комплементарности и стекинг-взаимодействий.
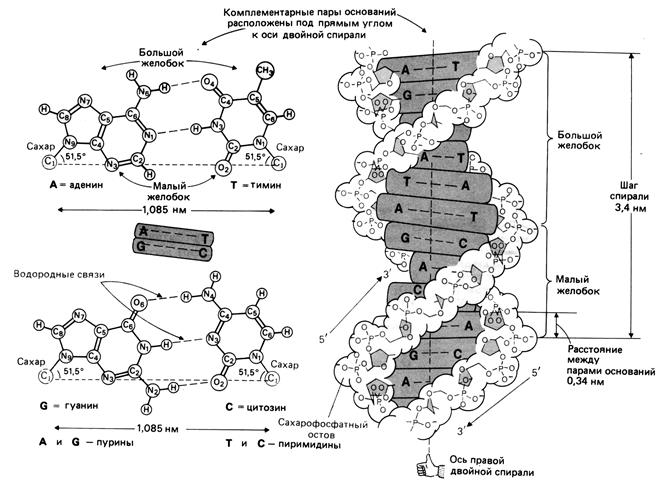
Рис. 1.4. Вторичная структура ДНК
Согласно трехмерной модели, предложенной Уотсоном и Криком, сахаро-фосфатный остов располагается по периферии двойной спирали, а азотистые основания находятся внутри, и их плоскости перпендикулярны оси спирали. Между основаниями образуются специфические водородные связи, в результате чего осуществляется так называемое уотсон-криковское спаривание. Аденин всегда образует две водородные связи с тимином, а гуанин образует три водородные связи с цитозином. Таким образом, более объемные пурины всегда спариваются с пиримидинами, имеющими меньшие размеры. Это приводит к тому, что расстояния между С1'-атомами дезоксирибозы в двух цепях оказываются одинаковыми для АТ- и GC-пар и равными 1,085 нм. В результате АТ- и GС-пары включаются в двойную спираль без какого-либо заметного изменения геометрии остова.
Диаметр двойной спирали равен примерно 2,0 нм. В двойной спирали ДНК образуются желобки. Это связано с тем, что сахарофосфатный остов расположен дальше от оси спирали, чем основания. В двойной спирали имеются два желобка-большой и малый.
Стабильность двойной спирали обусловлена разными взаимодействиями. Отчасти за нее ответственны водородные связи между основаниями. Однако, по-видимому, более важную роль играет межплоскостное взаимодействие-стэкинг. При этом обеспечиваются не только выгодные вандер-ваальсовы контакты между атомами, но и возникает дополнительная стабилизация благодаря перекрыванию p-орбиталей атомов контактирующих оснований. Стабилизация осуществляется также за счет благоприятного гидрофобного эффекта, проявляющегося в том, что неполярные основания защищены от непосредственного контакта с растворителем. Напротив, сахарофосфатный остов с его полярными группами и заряженными атомами экспонирован, что также стабилизирует структуру.
Для вторичной структуры характерно явление полиморфизма ДНК. Изменение физиологических условий приводит к переходу одной формы (конформации) ДНК в другую, что позволяет дополнительно регулировать работу генов. Т.о. полиморфизм ДНК -это способность двойной спирали принимать различные конформации. Рентгеноструктурные исследования кристаллов полинуклеотидов выявили четыре основных типа структур – А-, В-С- и Z-формы ДНК (рис.1.5).
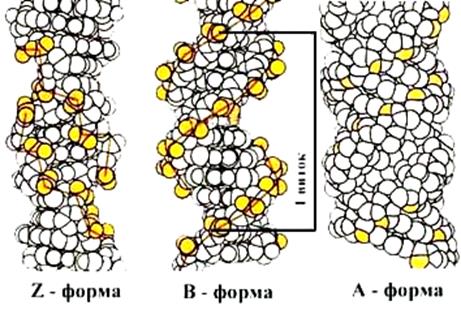
Рис. 1.5. Различные конформации ДНК
В-ДНК - этостандартная уотсон-криковская структура, в которой плоскости пар оснований перпендикулярны оси двойной спирали.
Соседние комплементарные пары повернуты друг относительно друга приблизительно на 360. В соответствии с последними данными на один виток спирали приходится 10,5 пар оснований, и шаг спирали соответственно равен 36 Å. Это правозакрученная спираль.
А-ДНК образуется при высушивании волокон В-ДНК, в водных растворах с повышенным содержанием калия и натрия или при добавлении спирта. Расстояние между нуклеотидами вдоль оси спирали составляет 2,56 Å. Высота витка спирали 28Å. На виток спирали здесь приходятся 11 пар оснований. Пары оснований в A-ДНК, так же как и в B-ДНК, почти плоские, но в этой форме они наклонены на 20 град. относительно перпендикуляра к оси спирали и смещены относительно оси на 4,7Å, так что ось попадает в большой желобок. Это приводит к появлению полости в центре структуры диаметром 5Å (рис. 1.6)

Рис. 1.6. А- и В- формы ДНК
С-ДНК также является правозакрученной спиралью. В этой форме ДНК шаг спирали составляет 31Å. На один виток спирали приходится 9,3 пар оснований. Угол наклона плоскости пар оснований к нормали оси спирали - 60.
Z- ДНК - левоспиральная (в отличие от A-, B- и С-ДНК) конформация ДНК. Она была открыта в 1979 г. при исследовании структуры гексануклеотида d(CG)3. Если полинуклеотид poly(dG-dC) поместить в водный раствор с высокой концентрацией MgCl2, NaCl или спирта, то образуется левая двойная спираль Z-ДНК. Повторяющейся единицей спирали является не пара нуклеотидов, а двойка соседних пар. Высота витка в Z-форме -44,5 Å, на виток приходится 12 пар нуклеотидов. Плоскости оснований примерно перпендикулярны оси спирали. Буква Z указывает на зигзагообразную форму сахарофосфатного остова ДНК в этой форме (рис.1.5).
В клетке ДНК обычно находится в В-форме, но отдельные ее участки могут находиться в А-, С-, Z- или даже иных конформациях.
У эукариот ДНК находится в специальном клеточном компатменте – ядре. В среднем на интерфазное ядро млекопитающих приходится около 2 м ДНК, которая локализуется в сферическом ядре со средним диаметром около 10 мкм. Т.е. молекула ДНК должна быть уложена с коэффициентом упаковки 1х103-1х104 в упорядоченную структуру обеспечивающую репликацию и транскрипцию молекулы. Третичная структура ДНК в эукариотических клетках отличается тем, что многократная спирализация ДНК сопровождается образованием комплексов с белками. Такая укладка обеспечивает формирование ядерного хроматина или в максимально конденсированном виде – метафазных хромосом (рис.1.7).
При образовании третичной структуры ДНК возможно образование трех- и четырехнитевых участков. Образование трехнитевых участков происходит благодаря так называемым Хугстэновским взаимодействиям (Hoogsteen base pairs), когда одновременно взаимодействуют три основания: А-А-Т, Т-А-Т, Г-Г-Ц, Ц-Г-Ц. Аналогичным образом происходит образование тетрамерных участков ДНК. Точный биологический смысл появления трех- и четырехнитевых участков ДНК пока не выяснен. Имеются только лишь предположения о том, что такие участки возникают в местах, наиболее ответственных за процессы репликации и транскрипции.
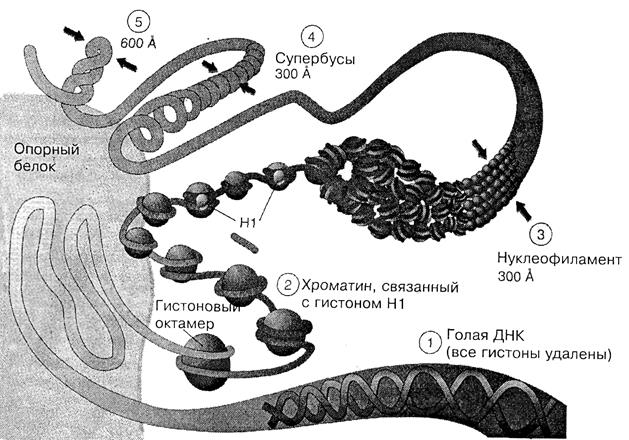
Рис. 1.7. Организация хромосомного материала
С хромосомными нитями ДНК связываются главным образом так называемые гистоны – небольшие сильно щелочные белки. Примерно 60-80% хромосомных белков представлены гистонами. Гистоны обогащены аминокислотами с основными (аргинин, лизин) и гидрофобными (валин и др.) радикалами (табл.1.1).
Таблица 1.1
Общие свойства гистонов млекопитающих
| Гистон | Молекулярная масса | Основные аминокислоты, % | Кислые аминокисло-ты, % | Отношение основных аминокислот к кислым | |
| лизин | аргинин | ||||
| H1 H2A H2B H3 H4 | 23 000 13 960 13 770 15 340 11 280 | 5,4 1,4 1,7 1,8 2,5 |
 Благодаря основным радикалам, гистоны взаимодействуют с ДНК, а благодаря гиброфобным радикалам – друг с другом. Эти взаимодействия приводят к образованию нуклеосом. Основа нуклеосомы - глобула из 8 белковых молекул (октамер) она включает по 2 молекулы гистонов 4-х видов (Н2А Н2В Н3 и Н4). Вокруг одной такой глобулы молекула ДНК делает примерно 2 оборота, что и образует в итоге нуклеосому (рис.1.8).
Благодаря основным радикалам, гистоны взаимодействуют с ДНК, а благодаря гиброфобным радикалам – друг с другом. Эти взаимодействия приводят к образованию нуклеосом. Основа нуклеосомы - глобула из 8 белковых молекул (октамер) она включает по 2 молекулы гистонов 4-х видов (Н2А Н2В Н3 и Н4). Вокруг одной такой глобулы молекула ДНК делает примерно 2 оборота, что и образует в итоге нуклеосому (рис.1.8).
Участки ДНК, «намотанные» на гистоновые октамеры, имеют длину в 140 нуклеотидных пар (н. п.) и называются коровыми (соrе-ДНК, или nDNA).
Нуклеосомы расположены на молекуле ДНК не вплотную: между ними имеются линкерные (соединительные) участки (iDNA) длиной 60 н. п. С каждым линкерным участком связана 1 молекула еще одного вида гистонов — Н1.
Следовательно, всего в хромосомах встречаются гистоны 5 видов, а период нуклеосомной организации составляет 200 н. п.
Молекула ДНК участвует в образовании очень большого числа нуклеосом (в среднем 600 000). В результате на данном уровне организации каждая хромосома (не считая негистоновых белков) представляет собой длинную нить «бусинок» — нуклеосом диаметром 10 нм. По сравнению с молекулой ДНК, длина нуклеосомной нити примерно в 6,2 раза меньше.
В интерфазном ядре хромосомы не различимы, а воспринимаются все вместе как хроматин. При этом выделяют гетеро- и эухроматин.
Гетерохроматин — сильно конденсированные и потому функционально неактивные участки хромосом. Они имеют вид плотных глыбок и интенсивно красятся базофильными красителями. Многие глыбки находятся на периферии ядра и прилежат к ядерной оболочке.
Напротив, эухроматин — функционально активные, практически деконденсированные и потому светлые участки хромосом, расположенные между глыбками гетерохроматина.
Нуклеосомный уровень организации имеется, видимо, и в гетеро-, и в эухроматине. Но в тех локусах эухроматина, на которых в данный момент времени функционируют ферментные комплексы (репликации, репарации или транскрипции), как полагают, ДНК высвобождается из взаимодействия с гисто-нами. Т. е. здесь нуклеосомная организация временно исчезает — с тем, чтобы впоследствии вновь восстановиться.
В отличие от этого, в гетерохроматине к нуклеосомному уровню добавляются последующие уровни укладки хромосомы. Считается, что нуклеосомная нить закручивается в спираль типа соленоида, а та, возможно, образует суперспираль. В этих процессах, видимо, ключевую роль играет гистон Н1. В итоге формируется хроматиновая нить диаметром 30 нм.
Хроматиновая нить короче нуклеосомной примерно в 18 раз и короче упакованной в ней молекулы ДНК в 6,2 х 18 @ 100 раз.
В свою очередь, хроматиновые нити образуют петли, которые собираются в розетки, где основания петель крепятся к белкам ядерного матрикса. В гетерохроматине такие группы петель более или менее плотно прилежат друг к другу.

Рис. 1.9. Схема начальных уровней компактизации хроматина
1- нуклеосомный; 2- нуклеомерный (30-нанометровая фибрилла); 3- хромомерный (петлевой домен); 4 - хромонемный
Наибольшей компактизации хромосомы достигают в процессе митоза (на стадии метафазы). Точная укладка хромосомных нитей при этом неизвестна.
По одной из версий, хроматиновая нить многократно складывается по длине хромосомы. Поэтому при микроскопии на поперечном срезе обнаруживается около 100 хроматиновых нитей (представляющих собой сечения одной и той же нити). Это приводит уже к 600-кратной компактизации ДНК (рис.1.9).
Кроме того, петли хроматиновой нити имеют длину не всей хромосомы, а лишь отдельных ее сегментов — хромомеров. Это объясняет возможность сегментации хромосом при тех или иных воздействиях.
ТЕМА 2 МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ РЕПЛИКАЦИИ ДНК
Один из важнейших внутриядерных процессов – репликация, или удвоение количества ДНК. Именно репликация ДНК обеспечивает воспроизведение наследственной информации при образовании новых клеток. Примерно в то же время происходит удвоение количества и хромосомных белков. Следовательно, репликация ДНК – составная часть более сложного процесса – репликации хромосом.
Репликативный синтез ДНК тесно связан с делением клетки.
Как известно, клеточные деления бывают двух типов: мейоз и митоз. Мейоз используется лишь в одном случае: так проходит последнее деление предшественников половых клеток. Остальные деления осуществляются путем митоза; это все предыдущие деления предшественников половых клеток, а также все деления соматических клеток.
Если обозначить количество ДНК в одинарном наборе хромосом через n, то его изменение в ходе указанных двух типов деления отразится рис. 2.1.
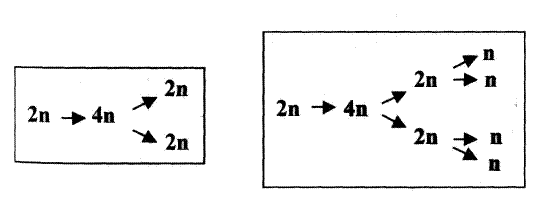
Рис. 2.1. Схемы митоза (слева) и мейоза (справа)
В обоих случаях ядро исходной клетки содержит обычный двойной набор хромосом и в нем – диплоидное (2n) количество ДНК; при подготовке к делению это количество путем репликации возрастает до тетраплоидного (4n), а в ходе последующего деления распределяется поровну между двумя дочерними клетками.
Но при мейозе добавляется еще одно деление, причем без предшествующей репликации ДНК; так что в итоге образуются четыре клетки с одинарным, или гаплоидным (п), количеством ДНК.
Следовательно, среди всех делений эукариотических клеток лишь в одном случае (во втором делении мейоза) не происходит предшествующего удвоения ДНК.
Отличным является и тот период клеточного цикла, когда совершается репликация ДНК.
В мейотических клетках (сперматоцитах и ооцитах) синтез ДНК считают началом профазы первого деления, а именно — прелептотенной стадией профазы. Затем следует лептотенная стадия профазы (конденсация хромосом). Причем в целом профаза мейоза (включающая шесть стадий) длится очень долго — около месяца в сперматоцитах и до нескольких десятилетий (включая длительный период покоя) в ооцитах.
В митотических же клетках, наоборот, между репликацией ДНК и началом профазы различают определенный промежуток времени, а сама профаза проходит достаточно быстро (не более нескольких часов).
2.1. Общая характеристика репликации ДНК
2.1.1. Основные принципы
Репликация ДНК имеет ряд принципиальных особенностей.
1. Субстратами, из которых синтезируются новые цепи ДНК, являются дезоксинуклеозидтрифосфаты (дНТФ), а не дезоксинуклеозид-монофосфаты (дНМФ), входящие в состав ДНК. Поэтому в ходе включения в цепь ДНК от каждого нуклеотида отщепляются 2 фосфатных остатка (в виде пирофосфата, который вскоре гидролизуется до фосфатов):

Использование именно дНТФ, а не дНМФ, объясняется энергетическими причинами: образование межнуклеотидной связи требует энергии; источником ее и служит разрыв межфосфатной связи.
2. Репликация ДНК — матричный процесс: каждая синтезируемая (дочерняя) цепь ДНК строится, используя в качестве матрицы одну из цепей исходной (родительской) ДНК.
Основой при этом является принцип комплементарности: из четырех возможных нуклеотидов (дАТФ, дГТФ, дЦТФ, дТТФ) в состав растущей цепи включается в данный момент тот, который комплементарен нуклеотиду в соответствующем положении родительской цепи.
3. Процесс (в отличие, например, от синтеза РНК) является симметричным: матрицами служат обе цепи родительской ДНК.
4. Процесс полуконсервативный: по завершении процесса исходные молекулы ДНК оказываются наполовину обновленными. В каждой из дочерних молекул одна цепь — родительская, а вторая — новосинтезированная.
5. Удлинение цепи ДНК (или отдельного ее фрагмента) всегда происходит в направлении от 5'-конца к 3'-концу. Это означает, что очередной новый нуклеотид присоединяется к 3'-концу растущей цепи.
Поскольку в любой молекуле ДНК комплементарные цепи антипараллельны, то и растущая цепь антипараллельна матричной цепи. Следовательно, последняя считывается в направлении 3' ®5¢
2.1.2. Основные механизмы репликации
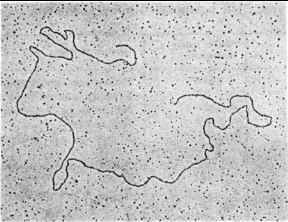
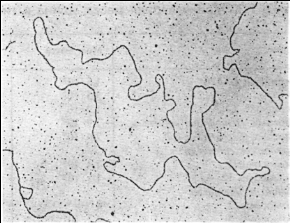
ДНК может находиться в линейной или кольцевой форме. Для эукариот и большинства прокариот характерна линейная двухцепочечная форма молекулы ДНК. Кольцевой двухцепочечной молекулой ДНК представлены бактериальные плазмиды, хромосомы некоторых бактерий, большинство митохондриальных и хлоропластных ДНК, геномы вирусов млекопитающих. Хромосома бактериофага λ на разных стадиях жизненного цикла существует то как линейная молекула, то как замкнутая кольцевая структура, то как кольцо с разрывами (рис.2.2).
| 
|
А Б
Рис. 2.2. Электронные микрофотографии линейной (А) и
кольцевой (Б) двухцепочечной ДНК фага λ.
По-видимому, никакого верхнего предела для размера кольцевой двухцепочечной молекулы ДНК не существует.
Вместе с тем не все ДНК являются двухцепочечными. Геномы некоторых мелких вирусов бактерий, растений и животных представляют собой ковалентно замкнутые кольца, состоящие только из одной цепи. Все известные одноцепочечные кольцевые ДНК относительно малы: ДНК бактериофагов φХ174 и М13 содержат примерно 5300 и 6000 нуклеотидов соответственно и имеют длину 1,5–2 мкм; длина молекул ДНК парвовирусов животных и некоторых вирусов растений составляет 2/3 и 1/2 указанных величин соответственно. Однако для репликации любой из этих вирусных ДНК совершенно необходимо превращение одноцепочечного кольца в соответствующее двухцепочечное, из которого затем образуются одноцепочечные кольцевые ДНК вирусного потомства. Более того, экспрессия генетической информации в таких геномах всегда осуществляется в фазе двухцепочечной ДНК, поскольку именно она является субстратом для транскрипции последовательности ДНК в РНК.
Для различных видов молекулы ДНК характерны отличия в механизме репликации. Выделяют двунаправленную и однонаправленную репликацию (рис.2.3).
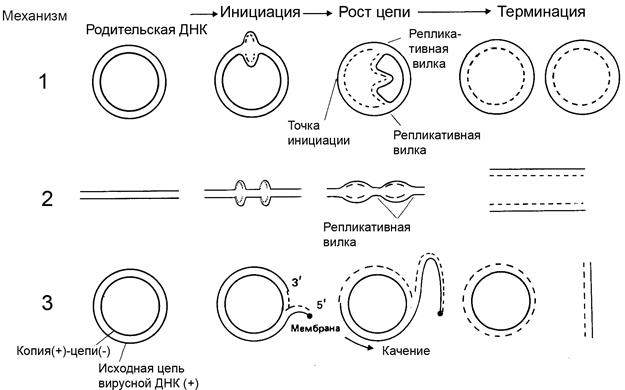
1 - Двунаправленная репликация с Q- петлей (напр. в E.coli)
2 - Двунаправленная репликация с множественной инициацией (эукариоты)
3 - Однонаправленная репликация: катящееся кольцо (напр., у фага Ф Х174).
Рис. 2.3. Механизмы двунаправленной и однонаправленной
репликации
Двунаправленная репликация – наиболее распространенный механизм репликации ДНК. После инициации репликация идет одновременно в обоих направлениях вдоль цепи ДНК. Для осуществления синтеза двойная спираль родительской ДНК должна раскрутиться и ее цепи должны разойтись. В этих процессах участвуют различные белки. В линейной ДНК раскручивание осуществляется путем вращения одной цепи вокруг другой. В двухцепочечной кольцевой ДНК раскручивание и репликация ведут к образованию структуры, напоминающей кольцо с внутренней петлей. Ее называют тэта-петля, поскольку по форме она похожа на греческую букву Q. Впервые такой механизм репликации был выявлен с помощью радиоавтографии Кэрнс для процесса репликации ДНК бактерий. Для визуализации ДНК культуру E.coli выращивали на среде, содержащей радиоактивные нуклеотиды, которые включались в ДНК. Затем реплицирующуюся ДНК наносили на фотопленку, на которой и получалось изображение Q-петли.
Однонаправленная репликация – более редкое явление. Она наблюдается у некоторых вирусов, содержащих одноцепочечную ДНК. При этом репликация происходит после образования двухцепочечной формы ДНК в клетке-хозяине. Механизм, с помощью которого это осуществляется, называется механизмом катящегося кольца. При этом в одной из цепей ДНК образуется разрыв (наружная цепи на рис.2.3), и синтез новой цепи начинается с 3¢-конца этой разорванной родительской цепи с использованием второй (внутренней на рисунке) в качестве матрицы. Это приводит к вытеснению 5¢-конца наружной цепи, которая впоследствии служит матрицей для синтеза новой цепи.
2.2. Особенности механизма репликации.
В настоящее время процесс репликации у прокариот достаточно изучен, в то время как многие аспекты эукариотической репликации остаются неясными. Однако с большой долей вероятности можно утверждать, что в большинстве клеток этот процесс протекает в основном одинаково.
2.2.1. Репликация ДНК прокариот
Ферментами, непосредственно, осуществляющими синтез новой цепи молекулы ДНК являются ДНК-полимеразы. У прокариот выделены три таких фермента: ДНК-полимераза I, II и III (pol I, pol II и pol III). Основная функция pol III- синтез новой цепи ДНК, pol I обеспечивает не только синтез, но и исправление ошибочно вставленных нуклеотидов. Полимераза II осуществляет особые, специализированные функции. Помимо 5¢®3¢-полимеразной активности все три фермента проявляют способность деградировать (разрушать) ДНК, отщепляя нуклеотиды в направлении 3¢®5¢, т.е. являются 3¢®5¢-экзонуклеазами. Pol I и pol III обладают также 5¢®3¢-экзонуклеазной активностью.
Поскольку синтез ДНК происходит на одноцепочечной матрице. Ему должно предшествовать обязательное разделение двух цепей ДНК. Участок начала расхождения цепей называется репликационной вилкой из-за характерной Y-образной формы (рис.2.4).
Именно в этой репликационной вилке ДНК-полимеразы синтезируют дочерние молекулы ДНК. Участок ДНК, в котором репликация уже завершилась, выглядит как пузырек или «глазок» в нереплицированной ДНК. Репликационные глазки образуются в тех местах, где находятся специфические последовательности – точки начала репликации (origin of replication). Они состоят примерно из 300 нуклеотидов. С ориджинами связываются инициаторные (узнающие) белки репликации. В случае бактерий такие белки называются DnaA. Инициаторные белки, обеспечив связывание ДНК-реплицирующиго комплекса ферментов, видимо, далее не перемещаются вместе с ним по ДНК.
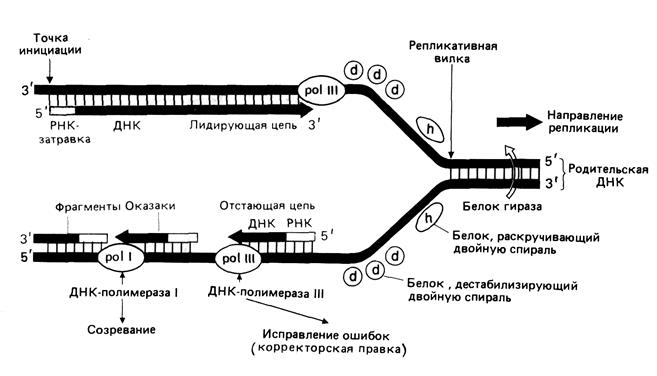
Рис.2.4. Репликация у E.coli
Для того, чтобы цепи ДНК разъединились, функционирует особый фермент – ДНК-геликаза (для бактерий это Rep-белок), который связывается с инициаторными белками. Этот фермент движется по одноцепочечной цепи ДНК и, встречая участок двойной спирали, он разрывает водородные связи между основаниями, разделяет цепи и продвигает репликационную вилку. На это затрачивается энергия гидролиза АТФ – по 2 молекулы АТФ на разделение 1 пары нуклеотидов. Одновременно происходит также вытеснение данного участка ДНК из связи с гистонами и другими хромосомными белками.
С одиночными цепями ДНК связывается специальные SSB-белки, дестабилизирующие спираль (SSB – single strand binding proteins). Они не позволяют им сомкнуться. Для того, чтобы репликационная вилка могла продвигаться вперед, вся еще не удвоенная часть ДНК должна была бы очень быстро вращаться. Белки ДНК-топоизомеразы вносят одноцепочечные или двуцепочечные разрыва, позволяющие цепям ДНК разделиться, а затем заделывают эти разрывы. Известны 2 таких фермента – топоизомераза I и топоизомераза II. Топоизомераза I разрывает одну из цепей ДНК, перенося ее проксимальный конец на себя. Это позволяет дистальному участку ДНК (от места расплетения до места разрыва) вращаться вокруг соответствующей связи целой цепи, что и предупреждает суперспирализацию нерасплетенных участков. Впоследствии концы разорванной цепи вновь замыкаются: один из них переносится с фермента на второй конец. Топоизомераза II (бактериальная топоизомераза II называется гиразой) разрывает сразу обе цепи ДНК, перенося соответствующие концы на себя. Это еще более эффективно позволяет решать проблему суперспирализации при расплетении ДНК.
Субстратом для ДНК-полимеразы являются дезоксирибонуклеозид-трифосфаты (дНТФ), полимеризующиеся на одноцепочечной матрице. ДНК-полимеразы последовательно наращивают одну нить ДНК, шаг за шагом присоединяя к ней следующие звенья в направлении от 5¢к 3¢ концу, причем выбор очередного дНТФ диктуется матрицей.
ДНК-полимеразы не могут начинать синтез ДНК на матрице, а способны только добавлять новые дезоксирибонуклеотидные звенья к 3¢-ОН- концу уже имеющейся полинуклеотидной цепи. Такую заранее образованную цепь, к которой добавляются нуклеотиды, называет затравкой (или праймером). Короткую РНК-затравку (длиной 10-60 нуклеотидов) синтезирует из рибонуклеозидтрифосфатов фермент, не обладающий корректирующей активностью и называемый ДНК-праймазой. Праймазная активность может принадлежать либо отдельному ферменту, либо одной из субъединиц ДНК-полимеразы.
Учитывая, что дочерние цепи ДНК растут только в направлении 5¢→3¢, синтез ДНК происходит непрерывно только на одной из матричных цепей. На второй (антипараллельной) цепи ДНК синтезируется сравнительно короткими фрагментами – от 100 до 1000 нуклеотидов, называемыми «фрагментами Оказаки» по имени открывшего их ученого – Тунеко Оказаки. Соответственно одна из цепей синтезируется быстрее и называется лидирующей, а вторая носит название запаздывающей.
Механизм работы ДНК-полимеразы на отстающей цепи до конца не изучен. В соответствии с одной из гипотез, полагают, что полимераза накладывает цепь ДНК, которая служит ей матрицей, саму на себя, что и обеспечивает разворот ДНК-полимеразы отстающей цепи на 180 градусов. (рис.2.5).
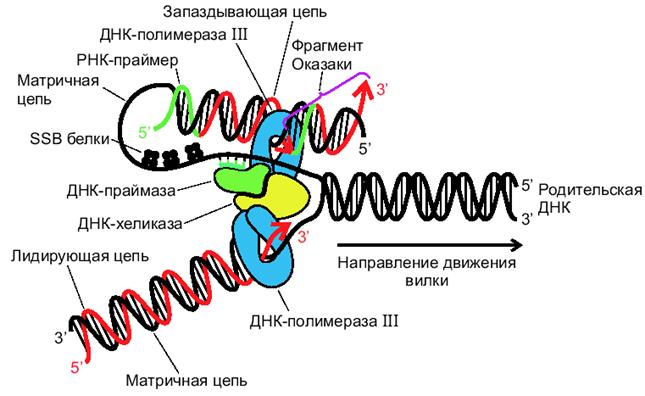
Рис. 2.5. Репликация ДНК («модель тромбона», Russell, 1998)
Такая модель репликации получила название «модель тромбона».
Генетический материал живых организмов имеет огромные размеры и реплицируется с высокой точностью. В среднем, в процессе воспроизведения генома млекопитающего, состоящего из ДНК длиной 3 млрд. пар нуклеотидов, возникает не более трех ошибок. При этом ДНК синтезируется чрезвычайно быстро (скорость ее полимеризации колеблется в пределах от 500 нуклеотидов в секунду у бактерий до 50 нуклеотидов в секунду у млекопитающих)
Высокая точность репликации, наряду с ее высокой скоростью, обеспечивается наличием специальных механизмов, осуществляющих коррекцию, т.е. устраняющих ошибки.
Суть механизма коррекции заключается в том, что ДНК-полимеразы дважды проверяют соответствие каждого нуклеотида матрице: один раз перед включением его в состав растущей цепи, второй раз перед тем, как включить следующий нуклеотид. Очередная фосфодиэфирая связь синтезируется лишь в том случае, если последний нуклеотид растущей цепи ДНК образовал правильную Уотсон-криковскую пару с соответствующим нуклеотидом матрицы.
В результате действия всех предыдущих ферментов каждая новосинтезированная цепь оказывается состоящей из фрагментов, вплотную примыкающих друг к другу. Удаление РНК-затравки с 5¢-концов всех синтезированных фрагментов осуществляет ДНК-полимераза I, действуя как экзонуклеаза. Этот же фермент на месте удаленной РНК встраивает дезоксинуклеотиды, используя при этом свою 5¢®3¢- полимеразную активность. «Сшивание» соседних фрагментов осуществляется ферментом ДНК-лигазой. Как и ДНК-полимеразы, этот фермент образует межнуклеотидную (фосфодиэфирную) связь. Но если в полимеразной реакции одним из участников является свободный дНТФ, то в ДНК-лигазной реакции оба участника - концевые дНМФ в составе «сшиваемых» фрагментов. По этой причине энергетика реакции иная, и требуется сопряженный гидролиз молекулы АТФ. Кроме того, ДНК-лигаза «сшивает» только такие одноцепочечные фрагменты, которые находятся в составе двухцепочечной ДНК.
Таким образом, процесс репликации хромосомы бактерий начинается в точке начала репликации и продолжается до тех пор, пока не удвоится вся ДНК хромосомы.
2.2.2. Репликация ДНК эукариот.
Хотя молекулярно-биологические процессы, происходящие во время репликации ДНК, в основном похожи у эукариот и прокариот, между ними имеется ряд существенных различий.
1. Если бактериальная хромосома представляет собой единицу репликации – репликон, то репликация ДНК эукариотической хромосомы осуществляется посредством разделения ее на множество отдельных репликонов. Полагают, что у эукариот гомологами ориджинов начала репликации являются автономно реплицирующиеся последовательности или ARS (autonomously replicating sequences). Сначала у дрожжей Saccharomyces cerevisiae были выделены особые последовательности, которые, будучи включенными в экстрахромосомальную ДНК, обеспечивали репродукцию этих ДНК в дрожжевой клетке. Позднее такие последовательности были выделены у многих других организмов.
2. У эукариот известно 5 разных ДНК-полимераз (a- b- e- d- и g-полимераза). Из них b- и e-полимеразы участвуют в репарации ДНК, g-полимераза — в репликации митохондриальной ДНК, а a- и d-полимеразы — в репликации ядерной ДНК. При этом альфа-полимераза контролирует рост лидирующей цепи, а дельта полимераза – запаздывающей.
По некоторым предположениям, a--полимераза связана и с праймазой, и с d-полимеразой, а последняя, в свою очередь, — с белком PCNA (от англ. Proliferation Cell Nuclear Antigen).
Данный белок выполняет роль «прищепки», которая крепит комплекс полимераз к реплицируемой цепи ДНК. Считается, что в «застегнутом» состоянии он, как кольцо, обхватывает цепь ДНК. Тем самым предупреждается преждевременная диссоциация полимераз от данной цепи.
3. Созревание фрагментов Оказаки у эукариот требует удаления РНК-затравок с помощью 5'®3'-экзонуклеазы (белковые факторы FEN-1 или MF-1) и РНКазы Н1, а также ковалентного соединения фрагментов друг с другом под действием ДНК-лигазы I.
По эукариотической хромосоме в каждый момент времени может двигаться независимо друг от друга множество репликационных вилок. Остановка продвижения вилки происходит только при столкновении с другой вилкой, движущейся во встречном направлении, или по достижении конца хромосомы. В результате вся ДНК хромосомы в короткий срок оказывается реплицированной.
Насколько велики репликоны и как много их в геноме? Трудность определения размеров и числа репликонов заключается в том, что трудно выделить индивидуальные «глазки» репликации. Всегда остается возможность, что наблюдаемый глазок является результатом слияния двух соседних репликонов. Чтобы обойти это препятствие, подбирают стадию репликации, когда число «глазков» максимально и они еще не начали сливаться. Затем в участке ДНК, содержащем несколько глазков, измеряют расстояние между начальными точками начала репликации (т.е. между средними точками смежных репликонов). Скорость движения вилки репликации определяют по максимальной длине радиоактивно меченого следа реплицирующейся ДНК в единицу времени.
Сведения о параметрах репликации представлены в таблице.
Параметры репликации ДНК в геномах эу- и прокариот (по Lewin, 1994)
| Организм | Число репликонов | Средняя длина репликона (в т.н.п.) | Скорость движения вилки репликации (в т.п.н./мин) |
| Бактерии (Escherichia coli) Дрожжи (Saccharomyces cerevisiae) Насекомые (Drosophila melanogaster) Лягушка (Xenopus laevis) Мышь (Mus musculus) Растения (Vicia faba) | 3,6 2,6 0,5 2,2 - |
ТЕМА 3. ПОВРЕЖДЕНИЕ И РЕПАРАЦИЯ ДНК
3.1. Повреждения ДНК
После рассмотрения процесса репликации ясно, что генетическая информация копируется с исключительно высокой степенью точности. Это связано с тем, что замены оснований в молекуле ДНК могут вызвать мутации, приводящие к нарушениям клеточных функций и гибели клеток. Следовательно, допустимы низкие частоты возникновения мутаций для сохранения жизни. Таким образом, как зародышевые, так и соматические клетки должны быть надежно защищены от генетических изменений.
Анализ частоты аминокислотных замен показывает, что белок среднего размера, состоящий из 400 аминокислот, изменяется случайным образом в результате одной аминокислотной замены приблизительно один раз в 200000 лет. Некоторые белки настолько консервативны, что даже такая низкая частота изменения аминокислот неприемлема для их нормального функционирования. Например, в молекуле гемоглобина одна замена на каждые 100 аминокислот происходит за 6 млн. лет. Гистон Н4 изменяется в сто раз медленнее. Особи, у которых замены происходят чаще, элиминируются естественным отбором. Это — еще одно подтверждение тому, что сохранение нуклеотидных последовательностей – необходимое условие сохранения жизни.
Между тем нуклеотиды в составе ДНК постоянно подвергаются изменениям под влиянием различных факторов. Факторы, вызывающие повреждения ДНК, достаточно разнообразны: внешние облучения (ультрафиолетовое, инфракрасное, радиоактивное и пр.), самопроизвольные локальные изменения температуры, свободные радикалы, химические мутагены и т. д.
Нередко есть связь между природой повреждающего воздействия и характером повреждений ДНК.
При этом последние можно подразделить на два основных типа:
1. повреждения оснований
2. повреждения цепей.
3.1.1. Повреждения оснований ДНК
Наиболее часто встречающимися повреждениями оснований ДНК являются (рис.3.1):
1. Гидролитическое выщепление оснований (апуринизация, апиримидизация)
Происходит спонтанно, а также под действием вышеперечисленных факторов. Особенно велика скорость выщепления пуриновых оснований. Выражается в потере (выщеплении) остатков аденина и гуанина из-за разрыва N-гликозидной связи между пурином и дезоксирибозой. Пентозофосфатный остов цепи при этом сохраняется.
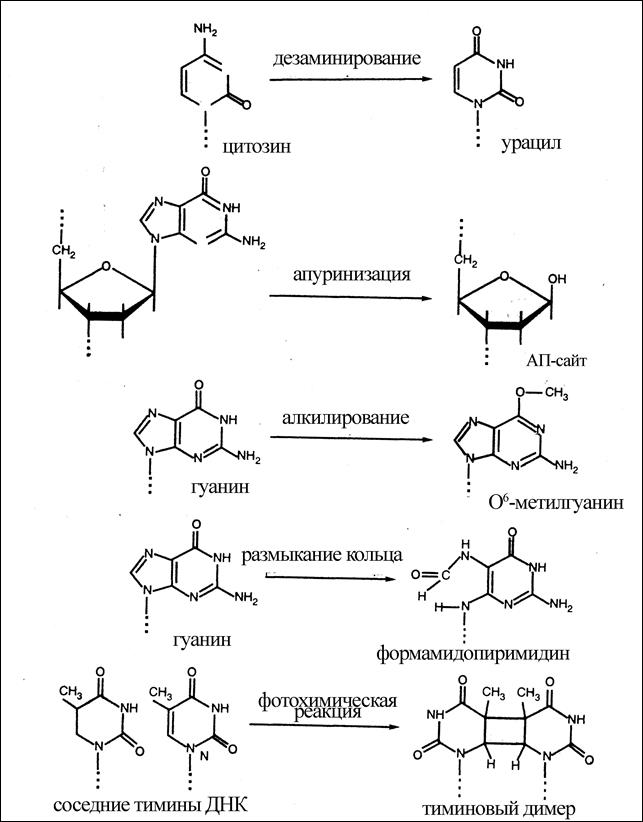
Рис. 3.1. Повреждение оснований ДНК
В среднем за сутки в диплоидной клетке молекулы ДНК теряют 5х104 таких оснований.
Если бы эти потери не репарировались, то за 70 лет в каждой неделящейся клетке организма молекулы ДНК лишились бы примерно 25% своих пуриновых оснований. Очевидно, клетки потеряли бы свою жизнеспособность задолго до этого срока.
Не менее драматичными были бы последствия и в делящихся клетках. Если бы сохранялся хотя бы один депуринизированный нуклеотид, то после репликации ДНК одна из дочерних цепей была бы лишена в данном месте уже целого нуклеотида. А после второй репликации появлялись бы молекулы ДНК, лишенные нуклеотидной пары, что меняло бы весь смысл генетической информации за поврежденным местом.
2. Гидролитическое дезаминирование оснований.
В данном случае теряется не целое основание, а только его аминогруппа. В ходе такого процесса происходит следующее:
- цитозин превращается в урацил — основание, которое в нормальных условиях содержится только в РНК;
- 5-метил цитозин превращается в тимин — обычное основание ДНК;
- аденин превращается в гипоксантин — основание, не встречающееся в норме ни в ДНК, ни в РНК.
Такие переходы меняют генетический смысл локуса. В частности, урацил и тимин комплементарны уже не гуанину (как цитозин и 5-метилцитозин), а аденину. Это будет проявляться при синтезе РНК или ДНК.
3. Алкилирование оснований.
Многие канцерогены алкилируют (например, метилируют или этилируют) основания. К таким канцерогенам относят нитрозоамины и нитрозоамиды. Обычно сайт для такой модификации – это О6-позиция гуанина и О4-позиция тимина. Эти атомы кислорода обычно находятся в кетоконфигурации для правильного спаривания оснований. Однако этилирование фиксирует эти атомы в енольной конфигурации, таким образом, дестабилизируя обычное углеродное связывание между основаниями в противоположных цепях, что часто приводит к возникновению точечной мутации.4. Разрыв пуринового кольца.
5. Образование димеров тимина- фотохимическая реакция
Инициируется ультрафиолетовым облучением и происходит там, где два тимидиловых нуклеотида соседствуют в цепи ДНК.
При этом между их основаниями замыкаются две ковалентные связи. В результате в данном локусе ДНК нарушаются структура двойной спирали и способность последней участвовать в синтезе ДНК и РНК.
3.1.2. Повреждения цепей ДНК
Среди повдеждений цепей ДНК выделяют:
1. Одноцепочечные разрывы: между соседними нуклеотидами цепи ДНК разрывается фосфодиэфирная связь (т. е. связь фосфатной группы и дезоксирибозы).
Особенно часто это происходит под влиянием рентгеновского и радиоактивного облучения. К такому же последствию может привести происшедшее до того выщепление азотистого основания из цепи ДНК.
При накоплении в ДНК большого количества разрывов нарушается структура хромосом — появляются т. н. хромосомные аберрации (видимые повреждения хромосом).
2. Поперечные сшивки. Это ковалентные связи двух видов:
· ДНК-ДНК, т. е. между основаниями двух цепей ДНК,
· ДНК-белок, т. е. между цепью ДНК и каким-либо белком хромосомы.
Такие сшивки блокируют в данном локусе синтез ДНК и РНК, поскольку в обоих этих процессах требуется расхождение цепей ДНК. В итоге, как видим, даже локальные повреждения структуры ДНК могут приводить к очень серьезным последствиям. Этим и объясняется наличие в клетках разнообразных систем репарации ДНК, специализирующихся на устранении определенных повреждений.
3.2. Репарация ДНК
3.2.1.Неэксцизионная репарация
В 1949 году немецкий генетик Альберт Кельнер обнаружил, что в клетках бактерий и грибов, таких как стрептомицеты и пенициллы, облученных ультрафиолетовым светом, а затем перенесенных на видимый свет, частота мутаций падает, а выживаемость резко возрастает по сравнению с клетками, оставленными после облучения в темноте. Кельнер пришел к выводу, что на свету проходят реакции восстановления и какие-то поврежденные молекулы или части их возвращаются к норме. Сходные явления были выявлены у бактериальных вирусов и высших организмов. Описанное явление было названо фотореактивацией.
Фотореактивация заключается в том, что фермент фотолиаза расщепляет образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. В 1963 году фотолиаза была выделена и очищена. В настоящее время выяснено, что в фотолиазе есть участок, либо сам служащий светочувствительным центром, который способен адсорбировать фотоны (в синей части спектра), либо связывающийся с кофакторами, адсорбирующими свет. Хотя тонкие реакции механизма поглощения света фотолиазами до сих пор до конца не понятны, ясно, что свет активирует фотолиазу, которая затем распознает димеры в облученной ДНК, присоединяется к ним и разрывает возникшие между пиримидиновыми кольцами связи. После этого фотолиаза отходит от ДНК. Это единственная пока найденная ферментная реакция, в которой фактором активации служит не химическая энергия, а энергия видимого света. Все остальные типы репарации не требуют активации светом и поэтому ранее назывались «темновой репарацией». Сейчас этот термин практически не встречается.
Репарация алкилированных оснований.
В 1978-1979 годах генетики и биохимики обнаружили, что метильная группа может отщепляться от алкилированного гуанина и тогда происходит прямое восстановление структуры ДНК в этой точке. В 1982-1988 годах было установлено, что такой же механизм функционирует при репарации алкилированного тимина. Последующие исследования показали, что в клетках есть белки метилтрансферазы, которые могут захватывать метильные группы от модифицированного гуанина и переносить их на собственный остаток цистеина. Благодаря этому и восстанавливается исходная структура ДНК. Метилтрансфераза, захватив метильную группу, не может от нее освободиться. Поэтому в прямом смысле эти белки не являются ферментами, так как последние не изменяются в ходе реакций. Таком образом, для каждого акта прямой репарации алкилированного гуанина или тимина нужна новая молекула белка и клетка вынуждена запускать синтез новых его порций. Как правило, внутри клетки их накапливается несколько тысяч. Если скорость возникновения повреждений ДНК превышает скорость синтеза метилтрансфераз, белки не успевают репарировать все повреждения и в клетках накапливаются мутации. В минуту в клетке E.coli может синтезироваться порядка 100 молекул метилтрансфераз. Следовательно мутации не возникнут, если скорость возникновения алкилированных оснований будет меньше 100 в минуту.
Репарация одноцепочечных разрывов ДНК.
Еще один тип реакций прямой репарации был обнаружен для одноцепочечных разрывов, индуцируемых, например, ионизирующим излучением. При этом с помощью фермента ДНК-полинуклеотидлигазы происходит прямое воссоединение разорванных концов в молекуле ДНК.
Репарация АП-сайтов.
Термин АП-сайт обозначает образование брешей в молекуле ДНК в результате выщепления пуриновых или пиримидиновых оснований. Описаны ферменты названные инсертазами (от англ. insert - вставлять), которые могут вставлять в брешь такое же основание, которые было до поражения, и соединять его с сахаром. Структура ДНК приобретает исходный неповрежденный вид.
3.2.2. Эксцизионная репарация
Существуют более сложные реакции восстановления, когда поврежденные участки вырезаются из цепи ДНК (отсюда происходит и термин „эксцизионная репарация»- от англ. excision – вырезание), а затем образовавшиеся бреши заполняются неповрежденными нуклеотидами.
Вырезание поврежденных оснований гликозилазами и застройка АП-сайтов.
К настоящему времени описано много типов ферментов – гликозилаз, каждый из которых узнает разнообразные поврежденные основания. Гликозилазы присоединяются к ним и разрывают гликозидные связи между поврежденным азотистым основание и сахаром дезоксирибозой. В результате образуется АП-сайт.
Такой АП-сайт распознается другим ферментом – АП-эндонуклазой, способной расщеплять сахарофосфатный остов внутри полимерной молекулы ДНК. Как только в цепи ДНК возникает разрыв, в работу вступает еще один фермент – фосфодиэстераза: он отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание.
Появляется брешь в одной цепи ДНК размером в один нуклеотид. Напротив бреши в противоположной нити ДНК расположен неповрежденный нуклеотид, и следующий фермент – ДНК полимераза I вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободной гидроксильной группе на 3¢ конце.
Чтобы соединить два свободных конца (3¢-ОН-конец восстановленного нуклеотида и 5¢-конец, ранее образовавшийся при разрыве цепи ДНК АП-эндонуклеазой), вступает в действие еще один фермент - полинуклеотидлигаза. Теперь вся структура ДНК полностью восстановлена: неправильное основание удалено, сахарофосфат, к которому это основание было прикреплено, вырезан из цепи ДНК, брешь заполнена правильным нуклеотидом, все одноцепочечные разрывы устранены. Так как последовательность реакций запущена в действие путем расщепления гликозидной связи, этот вид репарации получил название «вырезание оснований с помощью гликозилаз».
Вырезание нуклеотидов
Другим типом эксцизионной репарации является более сложная и энергетически более дорогая реакция вырезания не просто поврежденного основания, а значительного участка цепи ДНК перед и позади повреждения. (рис.3.2) Эту реакцию в клетках E.coli выполняет мультиферментный комплекс, содержащий эндонуклеазы, кодируемые тремя генами U vrA, U vrB и UvrC (названия генов даны по первым буквам слов ultra violet repair). Комплекс получил название «эксинуклеаза».
Процесс репарации включает следующие этапы:
1. Ферментный комплекс, состоящий из двух молекул белка, кодируемого геном UvrA и одной молекулы белка, кодируемого геном UvrB, распознает поврежденный участок и присоединяется к нему.
2.  За счет энергии гидролиза АТФ происходит изгиб молекулы ДНК в месте присоединения ферментного комплекса, изменение конформации белка uvrB и отсоединение димера белка uvrА.
За счет энергии гидролиза АТФ происходит изгиб молекулы ДНК в месте присоединения ферментного комплекса, изменение конформации белка uvrB и отсоединение димера белка uvrА.
3. К связанному с ДНК белку uvrB присоединяется белок uvrС. Совместно эти два белка вносят два одноцепочечных разрыва с обеих сторон от места повреждения ДНК – белок uvrB делает 3¢-разрыв, а белок uvrС - 5¢ разрыв.
4. Белок uvrD (геликаза) осуществляет расплетение ДНК в участке между двумя надрезами, что приводит к отсоединению содержащего повреждение фрагмента ДНК длиной 12 нуклеотидов (12-мер) с образованием бреши. При этом расходуется энергия еще одной молекулы АТФ.
5. ДНК полимераза I замещает белок uvrB и застраивает образовавшуюся брешь используя в качестве матрицы вторую цепочку ДНК.
6. С помощью ДНК лигазы осуществляется соединение свободных концов сахарофосфатного остова ДНК.
 Для млекопитающих требуется в среднем в четыре раза больше ферментов репарации, чем бактериям (эксинуклеаза состоит по крайней мере из 17 белков, затстройка бреши идет с участием ДНК полимераз s или e), а вырезаемый из поврежденной ДНК участок имеет длину не 12, а 29 и более нуклеотидов.
Для млекопитающих требуется в среднем в четыре раза больше ферментов репарации, чем бактериям (эксинуклеаза состоит по крайней мере из 17 белков, затстройка бреши идет с участием ДНК полимераз s или e), а вырезаемый из поврежденной ДНК участок имеет длину не 12, а 29 и более нуклеотидов.
Репарация неспаренных оснований.
Довольно часто
(у E.coli один раз на 10 тыс. нуклеотидов, а у эукариотов еще чаще) во время репликации ДНК происходят ошибки спаривания, в результате которых вместо комплементарной пары нуклеотидов А+Т или Г+Ц в дочернюю цепь ДНК оказываются включенными нуклеотиды, некомплементарные нуклеотидам в материнской цепи. Такие пары называют мисмэтчами (от англ. mismatch – несоответствие). Хотя ДНК-полимераза и способна сама исправлять такие ошибки в процессе репликации, иногда этот механизм не срабатывает, и тогда в ДНК по окончании репликации остаются невырезанными некоторые мисмэтчи. Такие ошибки репликации затрагивают только дочернюю цепочку ДНК, а матричная цепочка в процессе репликации остается неизменной.
Поэтому система репарации мисмэтчей работает только на дочерней цепи. Клетки при этом используют важное различие в структуре матричной и дочерней нитей, найденное в 70-х годах. Оказалось, что вскоре после окончания репликации специальные ферменты – метилазы присоединяют метильные группы к аденинам в последовательностях ГАТЦ. Поэтому во время следующего раунда репликации нити ДНК оказываются различными: материнская нить ДНК несет метилированные аденины, а в дочерней нити до окончания репликации аденины еще неметилированы. До начала метилирования клетка должна успеть отрепарировать мисмэтчи.
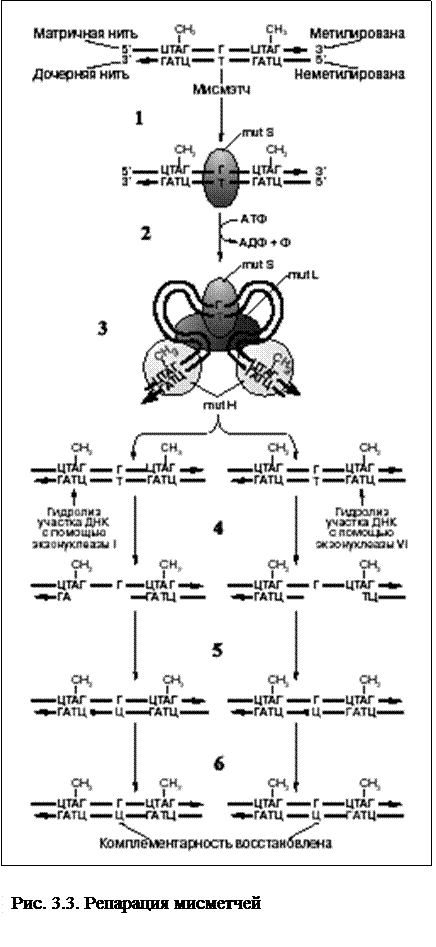
В кишечной палочке этот процесс идет под контролем продуктов четырех генов MutH, MutL, MutS и MutU (сейчас установлено, что MutU это уже известный ген UvrD, кодирующий белок-фермент геликазу) и включает следующие этапы (рис. 3.3):
1.Белок mutS распознает неспаренный участок – мисмэтч и присоединяется к нему.
2. За счет связывания с mutS мелекулы белка mutL и двух молекул белков mutH образу
Date: 2015-09-25; view: 1455; Нарушение авторских прав