
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтальпия
Внутренняя энергия. Химическая система может состоять из различных частиц: молекул, атомов или ионов. Каждая из частиц обладает энергией, которая обусловлена ее поступательными и вращательными движениями, колебаниями атомов и атомных групп в молекулах, силами притяжения и отталкивания, действующими как внутри частиц, так и между ними, внутриядерными взаимодействиями и т. д. (показать рисунок). Суммарный запас энергии системы, складывающийся из сильно различающихся энергий отдельных частиц, называют внутренней энергией системы. Ее обозначают буквой U. Внутренняя энергия - функция состояния системы, т. е. ее характеристика, в отличие от физических условий существования системы, которые называют параметрами. К числу параметров системы относятся температура Т, давление р и объем V, Определить экспериментально абсолютное значение внутренней энергии невозможно. Однако можно измерить изменение внутренней энергии:
ΔU=Uкон-Uнач

Первое начало термодинамики. В соответствии с первым началом термодинамики — законом сохранения энергии — теплота Q, подводимая к системе, расходуется на изменение внутренней энергии Δ U и на совершение работы А:
Q = Δ U + А
Работа, выполняемая химической системой, часто приводит к ее расширению. Если система не совершает других видов работы, например, электрическую или магнитную, то работу расширения можно рассчитать, пользуясь уравнением
A = pΔV
Если в системе происходит химическая реакция, не вызывающая изменения объема, т. е. если ΔV= 0, то и работа, выполняемая такой системой, тоже равна нулю. В этом случае вся поглощенная системой теплота расходуется на увеличение внутренней энергии системы:
Q = Δ U
Часто без изменения или с пренебрежимо малым изменением объема протекают реакции в системах, состоящих из твердых или жидких компонентов.
Энтальпия. Гораздо чаще реакции проходят при постоянном давлении. Таковы все реакции, осуществляемые экспериментаторами в открытой лабораторной посуде, и все природные процессы, происходящие на поверхности Земли. В ходе всех этих реакций давление не меняется. Оно равно атмосферному давлению (101,3 кПа). В процессах, происходящих при постоянном давлении, подводимая к системе теплота расходуется не только на увеличение внутренней энергии, но и на совершение работы А = рΔV, в результате которой увеличивается объем системы:
Q = ΔU + рΔV
Изменение объема ΔV равно разности конечного и начального объемов системы:
ΔV=Vкон-Vнач
Подставив в уравнение для Q выражения для разностей ΔU и ΔV получаем
Q = Uкон-Uнач +p(Vкон-Vнач)
или
Q = (Uкон+ pVкон) –(Uнач + pVнач)
В уравнении в скобках приведены конечное и начальное значения еще одной (наряду с внутренней энергией) функции состояния системы — энтальпии, которую обозначают буквой H:
H= U + pV.
Q = Hкон-Hнач= ΔH (5.7)
Величину ΔH называют изменением энтальпии в процессе или тепловым эффектом процесса, но часто используют сокращенные названия: теплота или энтальпия процесса.
Термохимия. Раздел химической термодинамики, изучающий тепловые эффекты химических процессов, называют термохимией.
Тепловой эффект процесса — количество теплоты выделенной или поглощенной в результате этого процесса.
Так как для создания и высокого, и низкого давления требуются огромные затраты энергии, подавляющее большинство химических реакций в природе, в промышленности и в лабораториях происходит при постоянном давлении, равном атмосферному. По этой причине чаще всего рассматривают тепловые эффекты при постоянном давлении. Их обозначают буквой Qр. В соответствии с уравнением (5.7) тепловой эффект процесса, происходящего при постоянном давлении, равен изменению энтальпии системы.
Если энтальпия реагентов больше, чем энтальпия продуктов реакции, то реакция сопровождается выделением теплоты, т. е. является экзотермической. В ходе экзотермической реакции энтальпия системы уменьшается, что соответствует отрицательному значению ΔH (рис. 5.2, а).
Наоборот, если энтальпия реагентов меньше энтальпии продуктов, то реакция происходит с поглощением теплоты, т. е. является эндотермической. В ходе эндотермической реакции энтальпия системы увеличивается, поэтому ΔH имеет положительное значение (рис. 5.2, б).

Термохимические уравнения. Химическое уравнение, в котором наряду с формулами реагентов, продуктов реакции и их стехиометрическими коэффициентами указан тепловой эффект, называют термохимическим уравнением. В термохимических уравнениях справа от формул веществ в скобках указывают агрегатное состояние: (г) — газообразное, (ж) — жидкое, (т) — твердое, (к) — кристаллическое, (р) — растворенное.
Для сравнения ΔH различных реакций их необходимо приводить к одинаковым условиям. Как правило, тепловой эффект реакций приводится для стандартных условий: давления 101,3 кПа (1 атм) и любой фиксированной температуры. Величины ΔH в этих условиях называют стандартными и обозначают ΔHoT. Верхний индекс o говорит о том, что тепловой эффект приводится для стандартного давления, а нижний индекс характеризует фиксированную температуру. Например, запи ΔHo400 = 22 кДж обозначает, что тепловой эффект какой-то реакции, осуществляемой при нормальном атмосферном давлении и температуре 400 К, равен 22 кДж. Чаще всего приводят значения ΔHoT для 298,15 К (25 °С) и вместо ΔHo 298,15 пишут просто ΔHo.
Следует отметить, что числовое значение теплового эффекта реакции зависит от формы записи термохимического уравнения. Например, уравнение реакции синтеза фтороводорода можно записать с дробными стехиометрическими коэффициентами у химических формул водорода и фтора:
1/2 Н2(г) + 1/2 F2(г) = НF(г); ΔHo = -270,7 кДж
Такая форма записи говорит о том, что превращение 0,5 моль газообразного водорода и 0,5 моль газообразного фтора в 1 моль газообразного фтороводорода при давлении 101,3 кПа и температуре 25 °С сопровождается выделением 270,7 кДж теплоты. (О том, что реакция происходит с выделением теплоты, т. е. является экзотермической, свидетельствует отрицательное значение ΔHo) Если это же уравнение записать с целочисленными коэффициентами, то числовое значение теплового эффекта будет в два раза больше, так как в два раза увеличиваются количества реагентов и продуктов реакции:
Н2(г) + F2(г) = 2 НF(г); ΔHo =-541,4 кДж
В обоих случаях при образовании 1 моль газообразного фтороводорода выделяется 270,7 кДж теплоты.
Стандартная молярная энтальпия образования. Абсолютное значение энтальпии вычислить невозможно, можно рассчитать только относительные значения в сравнении с ее значениями в стандартном состоянии. Стандартное состояние в химической термодинамике выбирают таким, чтобы было удобно проводить необходимые в каждом конкретном случае расчеты, поэтому определение стандартного состояния может изменяться в зависимости от поставленной задачи. Для процесса образования сложного вещества из простых веществ в качестве стандартного выбрано наиболее устойчивое состояние при стандартных условиях, т. е. при давлении 101,3 кПа и заданной температуре. В справочниках чаще всего приводят стандартную молярную энтальпию образования при температуре 298,15 К, которую обозначают как ΔHoобр, 298 или ΔHof, 298. В этих обозначениях верхний индекс ° — символ стандартного состояния, нижние индексы: обр. и / — сокращения соответственно от русского слова образование и английского formation, число 298 означает температуру 298,15 К (его часто опускают).
Стандартная молярная энтальпия образования - - изменение энтальпии при образовании 1 моль данного вешества в стандартном состоянии из простых вешеств, также находящихся в стандартном состоянии.
Стандартные энтальпии образования простых веществ в стандартных условиях принимают равными нулю. Если химический элемент в стандартных условиях образует несколько простых веществ (аллотропных модификаций), то в качестве стандартного состояния выбирают наиболее устойчивое из них. Например, для углерода стандартным состоянием считается графит, а для серы -- ромбическая форма. В таких случаях в скобках после химической формулы простого вещества указывают название наиболее устойчивой аллотропной модификации: С(графит), S(ромб).
Стандартные молярные энтальпии фазовых переходов. Энтальпия изменяется не только в результате химических реакций, но и при фазовых переходах: превращении одной аллотропной модификации в другую, плавлении и затвердевании, испарении и конденсации, сублимации и десублимации. Сублимация (возгонка) — переход твердого вещества непосредственно в газообразное, минуя плавление. Десублимация -- обратный процесс. Температура, при которой происходит фазовое превращение, называется температурой перехода. Приводимые в справочниках стандартные молярные энтальпии фазовых переходов представляют собой изменения энтальпии в результате фазового перехода 1 моль вещества, находящегося в стандартном состоянии при температуре перехода и нормальном атмосферном давлении. Для взаимно обратных процессов, например испарения и конденсации, молярные энтальпии равны по абсолютной величине, но обратны по знаку, поэтому в справочниках приводят значения только одной из этих величин. Например, приводимая в справочниках молярная энтальпия испарения воды ΔHoисп = 40,66 кДж/моль. Это означает, что для превращения 1 моль жидкой воды в водяной пар при температуре кипения 398,15 К (100 °С) и давлении 101,3 кПа нужно затратить 40,66 кДж теплоты. Положительное значение ΔHo пл свидетельствует о том, что этот процесс эндотермический. В результате обратного, экзотермического процесса конденсации 1 моль воды выделяет 40,66 кДж теплоты. Следовательно, ΔHo конд = = -40,66 кДж/моль.
Стандартные молярные энтальпии сгорания. Определить экспериментально теплоты образования подавляющего большинства органических веществ не удается, так как невозможно получить их прямым синтезом из простых веществ. Поэтому в термохимических расчетах для органических соединений используют найденные опытным путем теплоты сгорания этих веществ в кислороде. Стандартная молярная энтальпия сгорания — изменение энтальпии при полном сгорании 1 моль вещества в его стандартном состоянии при стандартных условиях. Для веществ, состоящих только из атомов углерода, водорода и кислорода, полное сгорание означает их превращение в СО2 и Н20. Продукты окисления других элементов определяют в каждом конкретном эксперименте.
Определяя экспериментально теплоты сгорания пищевых продуктов и кормов для сельскохозяйственных животных, устанавливают их энергетическую ценность. При этом тепловой эффект реакции относят не к количеству вещества в молях, а к его массе в граммах. Например, энергетическая ценность 100 г сахара равна 1680 кДж. В диетологии и в науке о кормлении сельскохозяйственных животных энергетическую ценность продуктов и кормов называют калорийностью и измеряют в ккал/г (1 ккал = 4,184 кДж).
Закон Гесса. Тепловые эффекты многих реакций не могут быть определены экспериментально, например, для многих веществ невозможно опытным путем определить энтальпию образования, потому что далеко не все сложные вещества можно получить прямым синтезом из простых веществ. В таких случаях прибегают к термохимическим расчетам, в основе которых лежит закон, установленный в 1840 г. российским ученым Г. И. Гессом.
Тепловой эффект химической реакции зависит только от начального и конечного состояний системы и не зависит от пути перехода.
Это означает, что если из данных реагентов данные продукты могут быть получены с помощью двух или нескольких различных последовательностей реакций, то сумма тепловых эффектов для каждой из этих последовательностей будет одной и той же. Примером является получение диоксида углерода из графита, которое можно осуществить двумя путями.
Первый путь: прямое окисление графита кислородом до С02:
С(графит) + О2(г) = СО2(г); ΔHo = -393,5 кДж
Второй путь: окисление графита сначала до СО, а затем окисление СО до СО2:
С(графит) +1/2О2(г) - СО2(г); ΔHo1 = -110,5 кДж
СО(г) + 1/2О2(г) = СО2(г); ΔHo2 = -283,0 кДж
В соответствии с законом Гесса
ΔHo= ΔHo1+ ΔHo2
в чем нетрудно убедиться, найдя сумму
ΔHo1+ ΔHo2 = -110,5 + (-283,0) = -393,5 кДж,
Из закона Гесса следует, что тепловой эффект реакции можно вычислить, если из суммы стандартных молярных энтальпий образования продуктов реакции вычесть сумму стандартных молярных энтальпий образования реагентов:
ΔHo реакции = Σ [ ΔHof, 298(продукты)] - Σ [ ΔHof, 298 (реагенты)].
При суммировании каждое значение ΔHof, 298 нужно умножать на стехиометрический коэффициент, стоящий в термохимическом уравнении перед формулой соответствующего вещества. Например, для реакции горения фосфина
4РН3(г) + 8О2(г) = Р4О10(т) + 6Н2О(ж) изменение энтальпии равно:
ΔHo реакции = ΔHof (Р4010) + 6 ΔHof (Н20) - [4 ΔHof (РН3) + 8 ΔHof (02)];
ΔHo реакции= -2984,00 + 6(-285,83) - [4 • 5,40 + 8 - 0] =
- -4720,58 кДж.
Тепловой эффект реакций с участием органических веществ, для которых известны стандартные молярные теплоты сгорания, в соответствии с законом Гесса можно вычислить, если из суммы стандартных молярных энтальпий сгорания реагентов вычесть сумму стандартных молярных энтальпий сгорания продуктов (суммирование следует осуществлять с учетом стехиометрических коэффициентов, как и в расчетах с использованием ΔHof, 298).
Тепловые эффекты реакций обычно слабо зависят от температуры, поэтому для их достаточно точной оценки, как правило, можно пользоваться значениями стандартных молярных энтальпий образования и сгорания для температуры 298,15 К. Для более строгих расчетов с учетом зависимости молярных энтальпий от температуры и давления предназначены специальные термодинамические справочники, позволяющие вычислять ΔH при других параметрах. Энтропия
Причины самопроизвольного протекания реакций. Среди самопроизвольных реакций известны как экзотермические (ΔHреакции < 0), так и эндотермические (ΔHреакции > 0) реакции. Следовательно, изменение энтальпии нельзя считать единственной причиной самопроизвольного протекания реакций. Очевидно, что есть, по меньшей мере, еще одна характеристика системы, изменение которой оказывает влияние на направление протекания процесса, наряду с ΔHреакции. Эта функция состояния системы называется энтропией и обозначается буквой S. Она была введена немецким физиком Р. Клаузиусом в 1865 г.
Качественное представление о содержании понятия энтропии можно получить из анализа такого эксперимента. Пусть два чистых газа, например кислород и азот, первоначально имеют одинаковые давление и температуру и содержатся в сосудах, соединенных трубкой с закрытым краном, как это показано на рис.. Если кран открыть, то газы приходят в соприкосновение и самопроизвольно смешиваются вплоть до достижения равновесных концентраций. Процесс смешения не сопровождается никакими тепловыми эффектами и после достижения равновесных концентраций самопроизвольного разделения газов никогда не происходит.
Совершенно ясно, что смесь кислорода и азота — их взаимный газовый раствор — является одновременно и более устойчивой, и более сложной системой, чем исходные чистые газы. Интуитивные представления и точный теоретический анализ дают одинаковый итог рассмотрения эксперимента по смешению газов: смесь, взаимный раствор газов, представляет собой более вероятное состояние, чем исходное состояние системы из двух чистых газов.
Анализируя опыт со смешением газов, можно сделать вывод: системы способны самопроизвольно изменяться при отсутствии энергетических стимулов, если они могут перейти в состояние, характеризуемое большей вероятностью
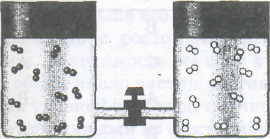
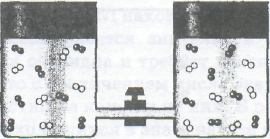
Рис. 5.3. Самопроизвольное смешение двух газов: а — кран закрыт; б — кран открыт
Термодинамическая вероятность. Чтобы уяснить смысл понятия вероятность состояния, рассмотрим пример с игрой в кости. Эта игра состоит в том, что два игрока бросают два кубика, на каждой грани которых проставлены очки от 1 до 6. Каждый из игроков перед бросанием называет сумму очков, которая, по его мнению, выпадет на верхних гранях двух костей. Если сумма действительно равна названной, игрок выигрывает ставку. Сумма очков может равняться 2, 3,..., 12. Вопрос о вероятности состояния в этой игре можно поставить так: какая сумма имеет наибольшую вероятность реализации?
Легко видеть, что вероятность выпадения суммы 7 вшестеро выше выпадения сумм 2 и 12. Действительно, суммы 2 и 12 могут выпасть каждая единственным образом 1 + 1 или 6 + 6, а сумма 7 может выпасть следующими шестью способами: 3 + 4; 4 + 3; 2+ 5; 5+ 2; 1 + 6; 6 + 1.
Таким образом, в качестве меры вероятности состояния системы можно избрать число способов, которыми это состояние может реализоваться.
Чтобы представить себе, как велико число способов реализации состояния с заданной суммой энергий молекул (макросостояния), рассмотрим пример, когда каждая из трех молекул А, В и С может иметь одну из трех различающихся между собой энергий: Е1, Е2 или Е3. Энергии Е1, Е2 и Е3, которыми могут обладать молекулы, называют энергетическими уровнями. Каждый из способов распределения молекул по уровням называют
Таблица 5.1. Способы распределения трех молекул:
А, В и С по трем различным энергетическим уровням; E1, Е2 и Е3
| Номер микросостояния | Молекулы с энергией | ||
| Е, | Е2 | Е3 | |
| А | В | С | |
| В | С | А | |
| С | А | В | |
| с | В | А | |
| А | С | В | |
| В | А | С |
микросостоянием. Все возможные способы распределения трех молекул по трем энергетическим уровням представлены в таблице, из которой видно, что число способов реализации макросостояния с энергией Е1 + Е2 + Е3 равно шести.
Если же N молекул распределяются по k уровням таким образом, чтобы на уровне с энергией Е1 было N1 молекул, на уровне Е2 было N2 молекул и т. д.:
Энергетический уровень Е1 Е2 Е3... Еi... Еk
Число молекул на уровне N1 N2 N3... Ni... Nk
то число микросостояний, отвечающих макросостоянию с энергией, равной сумме энергий N частиц, распределенных по k уровням, будет равно
w=N!/(N1! •N2!•N3!...Ni!...Nk!) (5.9)
Символом N! (факториал) обозначают произведение всех целых чисел от 1 до N, т. е. N! = 1 • 2 • 3 •... • N.
В рассмотренном выше примере с распределением трех молекул по трем энергетическим уровням на каждом энергетическом уровне было по одной молекуле, т.е. N1 = N2 = N3 = 1,
а общее число молекул N = 3, следовательно, число микросостояний
w=3!/(1! • 1! • 1!)
Число микросостояний, отвечаюшее данному макросостоянию, называют термодинамической вероятностью этого макроскопического состояния.
Согласно уравнению (5.9), числовые значения w тем больше, чем больше общее число частиц N = N1+N2 + N 3 +... +Ni+... +Nk и чем больше число энергетических уровней k.
Для больших множеств частиц вероятности их термодинамических состояний — всегда гигантские числа. Их крайне неудобно вычислять и измерять, поэтому вместо термодинамических вероятностей применяют математически равноценные им величины энтропии, которые пропорциональны натуральным логарифмам w. В расчете на 1 моль частиц энтропия S определяется через термодинамическую вероятность макросостояния вещества при помощи уравнения Больцмана — Планка:
S=Rlnw. (5.10)
где R — универсальная газовая постоянная.
Энтропия. В соответствии с уравнением (5.10) энтропия — мера вероятности данного состояния, т. е. числа способов, которыми это состояние может реализоваться.
Энтропия возрастает вместе со сложностью порядка, с помощью которого реализуется макросостояние. Но чем сложнее порядок, тем труднее его воспринимают, тем чаще его называют неупорядоченностью или беспорядком. Поэтому часто говорят, что энтропия — мера неупорядоченности, хаотичности системы.
Так же как внутренняя энергия и энтальпия, энтропия -функция состояния вещества. Она зависит от температуры, давления, фазового состояния вещества.
Второе начало термодинамики. Существует несколько эквивалентных формулировок этого фундаментального положения всей науки в целом. Одна из них звучит следующим образом:
при любых самопроизвольно протекающих процессах в изолированной системе ее энтропия не может убывать.
Для необратимых процессов в изолированных системах изменение энтропии ΔS > 0, для обратимых процессов ΔS = 0. Обратимым в термодинамике называют такой процесс, после которого система и ее окружение могут вернуться в начальное состояние таким образом, чтобы во всех участвующих в процессе телах не осталось никаких изменений. Обратимый процесс обязательно должен быть равновесным, т. е. проходить настолько медленно и осторожно, чтобы на каждом этапе превращения успевало возникать состояние, бесконечно близкое к равновесному. Все реальные процессы необратимы, лишь небольшое число из них можно приближенно рассматривать как обратимые. Таким образом, в результате реальных процессов энтропия изолированной системы всегда увеличивается.
Третье начало термодинамики. Это фундаментальное положение термодинамики, которое не является следствием первого и второго начал термодинамики:
при абсолютном нуле температуры энтропия кристалла, имеющего полностью упорядоченную структуру, равна нулю при любых значениях параметров состояния.
Эта формулировка третьего начала термодинамики была предложена М, Планком в 1911 г. Она означает, что для любого вещества можно на основе экспериментальных данных определить абсолютные значения энтропии, поскольку за точку отсчета принято ее нулевое значение.
Энтропию 1 моль вещества в его стандартном состоянии при давлении 101,15 кПа и фиксированной температуре называют стандартной молярной энтропией.
Стандартную энтропию обозначают символом SoT. Она измеряется в Дж/(моль·К). В справочниках чаще всего приводят числовые значения стандартной энтропии при температуре 298,15 К (25 °С) и обозначают ее символом S° без нижнего индекса.
Изменение энтропии при фазовых переходах. На рис. 5.4 показана зависимость энтропии металлического свинца от температуры.
Из этого рисунка видно, что с повышением температуры энтропия увеличивается. Она быстро растет в кристаллическом свинце за счет усиления колебаний атомов в решетке. При достижении температуры плавления происходит скачкообразное увеличение энтропии на величину ΔS ПЛ в результате фазового перехода, сопровождающегося резким возрастанием хаотичности системы. В твердой фазе атомы свинца располагались упорядочение в узлах кристаллической решетки. В жидкости же такого строгого порядка, распространяющегося на весь объем фазы, уже нет, хотя еще сохраняется так называемый ближний порядок вблизи каждого из атомов. Повышение температуры жид 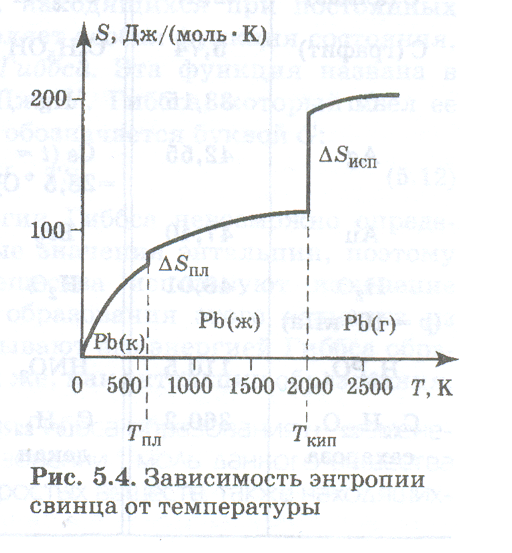
Кого свинца не вызывает такого быстрого роста энтропии, который наблюдается в кристаллическом состоянии. Однако при достижении температуры кипения происходит огромное увеличение энтропии на величину δs исп, потому что из жидкого состояния, в котором подвижность атомов свинца была ограничена их достаточно плотным взаимным расположением, свинец переходит в газообразное состояние, где атомы находятся друг от друга на расстояниях, значительно превышающих их собственные размеры, и могут свободно совершать любые хаотичные перемещения, образуя совершенно неупорядоченную систему. Энтропия паров свинца с повышением температуры возрастает незначительно.
Аналогичные изменения энтропии с ростом температуры и в результате фазовых переходов наблюдаются и у других веществ. Наименьшие числовые значения энтропии характерны для твердых кристаллических веществ. Причем они больше у веществ со сложной структурой молекул, в которых возможны колебательные и вращательные движения одних частей молекул относительно других. Особенно высоки числовые значения энтропии для газов.
Изменение энтропии в химических реакциях. Расчет изменения энтропии системы в результате химической реакции осуществляют аналогично расчету теплового эффекта реакции, используя уравнение
ΔSo реакции = Σ [ ΔSo (продукты)] - Σ [ ΔSo (реагенты)].
где Σ [ ΔSo (продукты)] - сумма энтропии продуктов реакции; Σ [ ΔSo (реагенты)]— сумма энтропии реагентов. При суммировании нужно учитывать стехиометрические коэффициенты перед формулами реагентов и продуктов.
Date: 2015-09-18; view: 2353; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |