
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Истинным химическим равновесием называют такое состояние реакционной системы, когда скорость прямой реакции равна скорости обратной реакции
Неизмененные при данных температуре и давлении концентрации компонентов системы, в которой установилось равновесие, называют равновесными. Обычно равновесные концентрации обозначают формулами веществ, заключенными в квадратные скобки, например, равновесные концентрации иода, водорода и иодоводорода можно записать так: [I2], [Н2], [НI]. Связь между равновесными концентрациями всех реагентов и продуктов реакции выражает закон действующих масс.
Отношение произведений концентраций продуктов реакции, взятых в степенях равных их стехиометрическим коэффициентам, к произведению концентраций реагентов, также взятых в степенях, равных их стехиометрическим коэффициентам, является постоянной величиной.
Эта постоянная называется константой равновесия. Для обратимой химической реакции, которую в общем виде можно изобразить уравнением
аА + bВ ↔ dD + gG
закон действующих масс можно математически описать следующим образом:
K=([D]d[G]g)/([A]a[B]b)
где К — константа равновесия; [D], [G] — равновесные концентрации продуктов реакции; d, g — их стехиометрические коэффициенты; [А], [В] — равновесные концентрации реагентов; а, Ь -их стехиометрические коэффициенты. Например, для обратимой реакции
Н2 + I2 ↔ 2НI
константу равновесия можно рассчитать по уравнению
K=([HI]2)/([H2][I2])
Подставив числовые значения равновесных концентраций, установившихся в экспериментах, получим K=50,7
В числителе константы равновесия записывают концентрации продуктов реакции, а в знаменателе - концентрации реагентов. В ходе реакции концентрации реагентов уменьшаются, а концентрации продуктов реакции увеличиваются. Следовательно, чем полнее происходит превращение исходных веществ в продукты реакции, тем больше числовое значение константы равновесия.
Содержание газов часто характеризуют парциальными давлениями. Парциальное давление — это давление, которое рассматриваемый газ производил бы на стенки сосуда, если бы он один занимал весь его объем. Константы равновесия для реакции с участием газообразных веществ можно рассчитывать как через молярные концентрации газов, так и через парциальные давления. Константы равновесия, рассчитанные через молярные концентрации Кс и через парциальные давления Кр, могут различаться.
Равновесные концентрации всех компонентов системы присутствуют в выражении для константы равновесия только в том случае, если равновесная система является гомогенной (на-
пример, состоит только из газов). Если же речь идет о гетерогенной системе, компонентами которой являются газообразные и твердые или газообразные и жидкие вещества, то концентрации твердых и жидких веществ в уравнение для расчета К не входят.
Например, константа равновесия для системы
FeO + CO ↔ Fe+CO2
равна отношению парциальных давлений газообразных оксидов углерода (IV) и (II):
Kp=P(СO2)/P(CO)
Проиллюстрировать динамический характер химического равновесия можно на следующем примере. Пусть одностадийная обратимая реакция описывается уравнением
2A ↔ B
Согласно закону действующих масс, скорость прямой реакции равна:
ʋ1=k1c2(A)
а скорость обратной реакции составляет:
ʋ2=k2c (B)
где k1 и k2 — константы скорости прямой и обратной реакций.
Если исходная система состоит только из вещества А, то скорость прямой реакции в начальный момент максимальна, а по мере превращения вещества А в вещество В уменьшается (рис.). Наоборот, скорость обратной реакции в начальный момент равняется нулю, так как исходная смесь не содержит вещества В. При возрастании концентрации вещества В в соответствии с последним уравнением растет и скорость обратной реакции. Обе скорости изменяются до тех пор, пока не станут равными, т. е. до наступления равновесия. В состоянии равновесия:
ʋ1= ʋ2
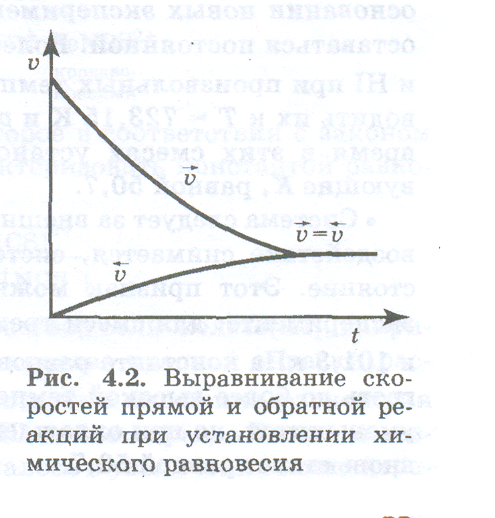
Эксперименты, проведенные для очень большого числа разнообразных обратимых реакций, позволили установить общие признаки истинного химического равновесия.
• При отсутствии внешних воздействий установившиеся равновесные концентрации не изменяются сколь угодно долго.
• Значение константы равновесия не зависит от того, подходит система к равновесию со стороны реагентов или со стороны продуктов. Этот признак хорошо демонстрируют эксперименты 1 и 2. Если провести при тех же температуре и давлении любое число экспериментов с самыми разнообразными начальными концентрациями водорода, паров иода и иодоводорода, в каждом случае будут устанавливаться не изменяющиеся со временем равновесные концентрации всех трех веществ. Эти концентрации будут отличаться от тех, что устанавливались в экспериментах 1 и 2, но вычисленная на основании новых экспериментов константа равновесия будет оставаться постоянной. Более того, если готовить смеси Н2, I2 и НI при произвольных температуре и давлении, а затем приводить их к Т = 723,15 К и р = 101,3 кПа, то через некоторое время в этих смесях установятся концентрации, соответст-
вующие К, равной 50,7.
• Система следует за внешними воздействиями, если внешнее воздействие снимается, система возвращается в исходное состояние. Этот признак можно продемонстрировать на таком эксперименте: для смеси трех газов (Н2, I2 и НI) при 723,15 К и 101,3 кПа константа равновесия К = 50,7. Если эту смесь нагреть до более высокой температуры, то константа равновесия уменьшится, но при охлаждении до исходной температуры она вновь станет равной 50,7.
Date: 2015-09-18; view: 459; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |