
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Значение химической кинетики
Использование законов химической кинетики позволяет управлять скоростями реакций и повышать производительность химических аппаратов. Например, каталитические процессы составляют основу производства азотных удобрений, высокооктанового топлива для двигателей внутреннего сгорания, пестицидов, огромного числа других химических продуктов сельскохозяйственного и иного назначения. Более 80% химических реакций в химической промышленности проводят с использованием катализаторов.
Химическая кинетика объясняет механизмы огромного множества химических реакций, происходящих в живой клетке. Без согласования скоростей различных контролируемых ферментами биохимических реакций невозможна нормальная жизнедеятельность любой клетки. Поэтому методы генной инженерной и молекулярной биологии — это прежде всего методы управления скоростями биохимических реакций.
Некоторые кинетические закономерности проявляются в сельском хозяйстве. Например, ускорение роста растений с повышением температуры связано с тем, что с увеличением температуры возрастают скорости почти всех реакций. Разные культуры быстро развиваются при неодинаковых оптимальных температурах. В этом проявляется «настроенность» ферментативных систем растений на определенные температуры. Сельскохозяйственные продукты хранят при пониженных температурах, так как охлаждение замедляет нежелательные ферментативные процессы. И т.д.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Основные понятия и признаки химического равновесия
Системы* (cистема — это материальный объект, обособленный от окружающей среды физическими или воображаемыми границами. Смесь газообразного водорода и паров иода, помещенная в герметично закрытый сосуд, представляет собой систему, отделенную от окружающей среды физическими границами — стенками сосуда), в которых протекают химические реакции, могут достигать специфического конечного состояния — химического равновесия. Для уяснения смысла понятия химическое равновесие рассмотрим результаты двух экспериментов.
В первом эксперименте, как и в раннем примере, в герметично закрытый сосуд помещены равные объемы газообразного водорода и паров иода при температуре 723,15 К (450 °С) и давлении 101,3 кПа. По истечении некоторого времени взаимодействие Н2 и I2, описываемое уравнением
Н2 +I2 → 2НI
как будто прекратилось, так как концентрации этих веществ установились на уровне 0,184 ммоль/л, а концентрация HI стала равной 1,31 ммоль/л (см. рисунки).
Во втором эксперименте в герметично закрытый сосуд был помещен только иодоводород при тех же, что и в первом эксперименте, температуре и давлении. В этом случае происходит реакция, обратная той, что происходит в первом эксперименте:
2HI → Н2 +I2
По истечении определенного времени и в этом эксперименте прекратилось изменение концентраций всех трех веществ и установились те же концентрации, что и в первом эксперименте (рис. 4.1).
В обоих экспериментах в смеси газов установилось химическое равновесие, внешние (макроскопические) проявления которого заключаются в том, что концентрации веществ, образующих данную химическую систему, перестают меняться и остаются постоянными во времени, если не изменяются внешние условия. Установление постоянных концентраций — один из важнейших, но недостаточный признак истинного химического равновесия.

Концентрации компонентов не изменяются во времени не только при установлении истинного химического равновесия, но и в метастабильном состоянии (кажущееся равновесие), а также при стационарном состоянии. Метастабильное состояние обусловлено существованием высоких энергетических барьеров, для преодоления которых внутри системы не хватает энергии (подробнее см. раздел 4.3). Стационарное состояние поддерживается в открытой системе* (Система называется закрытой, если она обменивается со своим окружением энергией, но ее границы непроницаемы для вещества. В описанных экспериментах рассматриваются закрытые системы. Открытые системы обмениваются с окружающей средой как энергией, так и веществом. Открытыми системами, например, являются живые организмы и экосистемы) в результате поступления в нее из окружающей среды потоков вещества и энергии.
Чтобы сформулировать признаки, отличающие истинное химическое равновесие, рассмотрим, как возникает состояние истинного химического равновесия, и определим его важнейшую количественную характеристику — константу равновесия. Химическое равновесие может устанавливаться только в тех системах, где происходят обратимые реакции. Реакция является обратимой, если в системе одновременно с взаимодействием реагентов, приводящим к образованию продуктов (прямая реакция), происходит превращение продуктов обратно в реагенты(обратная реакция). Например, в первом эксперименте прямой реакцией является превращение водорода и иода в иодоводород, но как только появляются первые молекулы НI, начинает протекать обратная реакция — разложение иодоводорода. При записи уравнений обратимых химических реакций вместо знаков равенства или стрелки используют знак 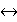 Например, обратимую реакцию, протекающую в смеси водорода, иода и иодоводорода, можно изобразить уравнением
Например, обратимую реакцию, протекающую в смеси водорода, иода и иодоводорода, можно изобразить уравнением
Н2 + I2 ↔2НI
Следует отметить, что установление равновесия не означает действительного прекращения протекания реакций. В рассмотренных экспериментах концентрации водорода и иода остаются в состоянии равновесия постоянными не потому, что молекулы Н2 и I2 перестают реагировать друг с другом, образуя НI, а потому, что число молекул Н2 и I2, расходующихся за какой-то промежуток времени, точно равно числу молекул Н2 и I2, появляющихся в реакционной смеси в результате разложения иодоводорода. Концентрация иодоводорода, в свою очередь, не меняется не потому, что прекращается образование и разложение молекул НI, а потому, что в единицу времени разлагается и образуется равное число этих молекул. Из сказанного можно сделать вывод, что истинное химическое равновесие имеет динамический характер, и дать определение химического равновесия.
Date: 2015-09-18; view: 1491; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |