
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Скорость химической реакции
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика — раздел химии, изучающий скорость химических реакций, механизмы их протекания и факторы, влияющие на скорость.
Химическая кинетика подробно изучается в курсе физической химии. Мы рассматриваем только те представления и понятия, без которых нельзя правильно понять такие вещи как «Химическое равновесие», «Энергетика химических реакций», а также многие свойства химических элементов и их соединений.
Все химические реакции, подобно физическим, биологическим, геологическим и любым другим природным процессам, протекают во времени. Химическая кинетика изучает и очень быстрые, такие, как взрывы, и очень медленные реакции, такие, как геохимическое формирование земных пород. Это возможно потому, что все химические реакции подчиняются общим законам.
Реакции делятся на гомогенные и гетерогенные. Гомогенные реакции протекают равномерно во всем объеме жидкого раствора или газовой смеси. Гетерогенные реакции осуществляются на поверхности твердого вещества, взаимодействующего с жидкостью или газом, или на поверхности жидкости, реагирующей с газом.
Чтобы понять, что такое скорость химической реакции, рассмотрим, например, газовую смесь, состоящую из равных объемов водорода и паров иода, помещенную при температуре 723,15 К (450 °С) и давлении 101,3 кПа в герметично закрытый сосуд. Пары иода окрашивают смесь в фиолетовый цвет. Наблюдая за этой смесью, можно заметить ослабление фиолетовой окраски, что свидетельствует о протекании гомогенной реакции:
Н2 + I2 → 2НI
бесцветный фиолетовый бесцветный
Интенсивность окраски смеси тем меньше, чем меньше содержащееся в ней количество иода. Следовательно, о скорости реакции можно судить по изменению количества вещества реагента или продукта реакции.
Скорость химической реакции — это количество вещества реагента, вступившего в реакиию за единицу времени, или количество вещества продукта, образовавшегося за единицу времени, в единице объема при гомогенной реакции или на единице поверхности при гетерогенной реакции.
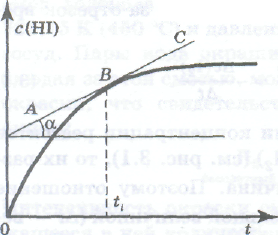
Отношение количества вещества (моль) к единице объема (л) — это не что иное, как молярная концентрация вещества, поэтому скорость гомогенной реакции обычно характеризуют изменением концентрации вещества-реагента или вещества-продукта за единицу времени при постоянном объеме системы. Установив зависимость интенсивности окраски от концентрации иода, можно.проследить за изменением его концентрации во времени (рис. 3.1). Зная концентрации иода с1(I 2)в момент времени t1 и с2(I 2) в момент времени t2, можно найти среднее значение скорости реакции  по одному из реагентов, иоду, за отрезок времени Δt=t2-t1:
по одному из реагентов, иоду, за отрезок времени Δt=t2-t1:
 (I2) = [c2(I2)-c1(I2)] / [t2-t1] = Δc(I2)/Δt
(I2) = [c2(I2)-c1(I2)] / [t2-t1] = Δc(I2)/Δt
-

Рмс. 3.1. Изменение концентра- Рис. 3.2. Изменение концентра
ций реагента с(I2) в зависимости ции продукта реакции с(HI) в за-
от времени t реакции висимости от времени реакции t
Так как по мере протекания реакции концентрации реагентов убывают, т. е. с2(I2) меньше, чем с1(I2) (см. рис. 3.1), то их разность Δс(I2) — отрицательная величина. Поэтому отношение Δс(I2)/Δt также оказывается отрицательной величиной (Δt — величина всегда положительная). Чтобы средняя скорость реакции по реагенту имела положительное значение, это отношение в уравнении (3.1) взято со знаком минус,
Если существует возможность следить за изменением концентрации продукта реакции — иодоводорода (рис. 3.2), то среднюю скорость можно вычислить следующим образом:
 (HI) = [c2(HI)-c1(HI)]/[t2-t1] = Δc(HI)/Δt
(HI) = [c2(HI)-c1(HI)]/[t2-t1] = Δc(HI)/Δt
где c1(HI) и c2(HI) — концентрации продукта реакции в моменты времени t1 и t2соответственно.
Из рис. 3.1 и 3.2 видно, что в начале реакции концентрации веществ изменяются быстро, затем эти изменения замедляются и, наконец, прекращаются совсем. (Неполное превращение иода и водорода в иодоводород и установление постоянных концентраций всех компонентов реакционной смеси объясняются достижением химического равновесия, которое будет рассмотрено далее. Следовательно, среднее значение скорости зависит от того, в какой части кривой выбран промежуток времени Δt = t2 - t1 и насколько он велик. Чем меньше Δt, тем меньше различие между средней скоростью и истинным (мгновенным) значением скорости в данный момент времени. Мгновенное значение скорости  может быть вычислено как предел, к которому стремится средняя скорость при Δt → 0, т. е. как первая производная от концентрации по времени. Истинная скорость по реагенту (иоду):
может быть вычислено как предел, к которому стремится средняя скорость при Δt → 0, т. е. как первая производная от концентрации по времени. Истинная скорость по реагенту (иоду):

Графически истинную скорость можно определить как тангенс угла наклона α касательной к кривой, изображающей зависимость концентрации от времени, при данном времени ti.
Главные факторы, определяющие скорость реакций, — это природа реагентов, наличие катализаторов, концентрации реагентов, температура.
Очень важным фактором является химическая природа реагентов. Именно из-за химического разнообразия веществ одни реакции идут медленно, а другие — очень быстро. Зависимости скоростей от природы реагентов — это специальная, очень обширная область физической химии и химической физики. Зависимость скорости химической реакции от концентраций реагентов, температуры и наличия катализатора рассматривается далее.
|
Date: 2015-09-18; view: 412; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |