
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Облако 1з-электрона
|
|

На рис. изображены значения волновой функции Ѱ (рис. а) и ее квадрата (рис. б} для 1s-электрона в зависимости от расстояния от ядра г. 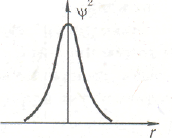

Изображенные кривые не зависят от направления, в котором откладывается измеряемое расстояние г; это означает, что электронное облако 1s -электрона обладает сферической симметрией, т. е. имеет форму шара. Кривая на рис. а расположена по одну сторону от оси расстояний (ось абсцисс). Отсюда следует, что волновая функция 1s-электрона обладает постоянным знаком; будем считать его положительным.
Рис. б показывает также, что при увеличении расстояния от ядра величина Ѱ2 монотонно убывает. Это означает, что по мере удаления от ядра плотность электронного облака 1s-электрона уменьшается.
Из этого не следует, однако, что с ростом r вероятность обнаружить 1s-электрон тоже монотонно убывает. На следующем рис. выделен тонкий слой, заключенный между сферами с радиусами r и (r + Δ r), где Δ r — некоторая малая величина.
С ростом r плотность электронного облака в рассматриваемом сферическом слое уменьшается; но одновременно возрастает объем этого
слоя, равный 4  r2Δr. Как уже говорилось, вероятность обнаружить электрон в малом объеме ΔV выражается произведением Ѱ2ΔV, В данном случае ΔV = 4
r2Δr. Как уже говорилось, вероятность обнаружить электрон в малом объеме ΔV выражается произведением Ѱ2ΔV, В данном случае ΔV = 4  r2Δr; следовательно, вероятность обнаружения электрона в сферическом слое, заключенном между r и (r + Δ r), пропорциональна величине 4
r2Δr; следовательно, вероятность обнаружения электрона в сферическом слое, заключенном между r и (r + Δ r), пропорциональна величине 4  r2 Ѱ2. В этом произведении с увеличением r множитель 4
r2 Ѱ2. В этом произведении с увеличением r множитель 4  r2 возрастает, а множитель Ѱ2 убывает. При малых значениях r величина 4
r2 возрастает, а множитель Ѱ2 убывает. При малых значениях r величина 4  r2 возрастает быстрее, чем убывает Ѱ2, при больших — наоборот. Поэтому произведение 4
r2 возрастает быстрее, чем убывает Ѱ2, при больших — наоборот. Поэтому произведение 4  r2 Ѱ2, характеризующее вероятность обнаружения электрона на расстоянии r от ядра, с увеличением r проходит через максимум.
r2 Ѱ2, характеризующее вероятность обнаружения электрона на расстоянии r от ядра, с увеличением r проходит через максимум.
Зависимость величины 4  r2 Ѱ2 от r изображена для 1s-электрона на рис. (подобные графики называются графиками радиального распределения вероятности нахождения электрона).
r2 Ѱ2 от r изображена для 1s-электрона на рис. (подобные графики называются графиками радиального распределения вероятности нахождения электрона).
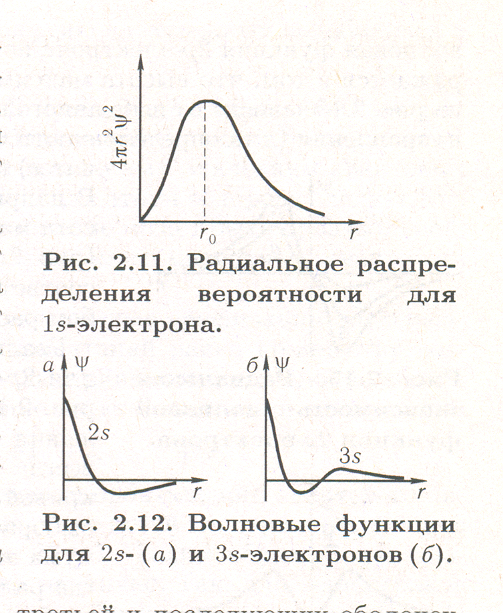
Как показывает рис.2.11, вероятность обнаружить 1s-электрон на малых расстояниях от ядра близка к нулю, так как r мало. Ничтожно мала и вероятность обнаружения электрона на очень большом расстоянии от ядра: здесь близок к нулю множитель Ѱ2 (см. рис. ранее ). На некотором расстоянии от ядра r0 вероятность обнаружения электрона имеет максимальное значение. Для атома водорода это расстояние равно 53 пм, что совпадает с вычисленным Бором значением радиуса ближайшей к ядру орбиты электрона. Однако трактовка этой величины в теории Бора и с точки зрения квантовой механики различна: согласно Бору, электрон в атоме водорода находится на расстоянии 53 nm от ядра, а с позиций квантовой механики этому расстоянию соответствует лишь максимальная вероятность обнаружения электрона.
Электронные облака s-электронов второй, третьей и последующих оболочек обладают, как и в случае 1s-электронов, сферической симметрией, т. е. характеризуются шарообразной формой. Однако здесь волновая функция при увеличении расстояния от ядра меняется более сложным образом. Как показывает рис. 2.12, зависимость Ѱ от r для 2s- и Зs-электронов не является монотонной, на разных расстояниях от ядра волновая функция имеет различный знак, а на соответствующих кривых есть узловые точки (или узлы), в которых значение волновой функции равно нулю. В случае 2s-электрона имеется один узел, в случае 3s-электрона — 2 узла и т. д. В соответствии с этим, структура электронного облака здесь также сложнее, чем у 1s-электрона. На рис. 2.13 в качестве примера схематически изображено электронное облако 2s-электрона.
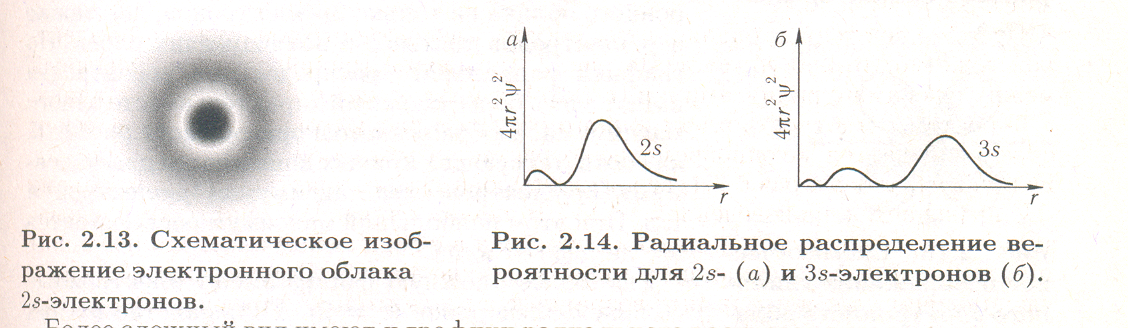 Более сложный вид имеют и графики радиального распределения вероятности для 2s- и 3s-электронов (рис. 2.14). Здесь появляется уже не один максимум, как в случае 1s-электрона, а соответственно два или три максимума. При этом главный максимум располагается тем дальше от ядра, чем больше значение главного квантового числа n.
Более сложный вид имеют и графики радиального распределения вероятности для 2s- и 3s-электронов (рис. 2.14). Здесь появляется уже не один максимум, как в случае 1s-электрона, а соответственно два или три максимума. При этом главный максимум располагается тем дальше от ядра, чем больше значение главного квантового числа n.
Рассмотрим теперь структуру электронного облака 2p-электрона. При удалении от ядра по некоторому направлению волновая функция 2p-электрона изменяется в соответствии с кривой, изображенной на рис. 2.15, а.
По одну сторону от ядра (на рисунке — справа) волновая функция положительна, и здесь на кривой имеется максимум, по другую сторону от ядра (на рисунке — слева) волновая функция отрицательна, на кривой имеется минимум; в начале координат значение Ѱ обращается в нуль. В отличие от s-электронов, волновая функция 2р-электрона не обладает сферической симметрией. Это выражается в том, что высота максимума (и, соответственно, глубинаминимума) на рис, 2.15 зависит от выбранного направления радиуса-вектора r. В некотором направлении (для определенности будем считать его направлением оси координат х) высота максимума наибольшая (рис. 2.15, а). В направлениях, составляющих угол с осью х, высота максимума тем меньше, чем больше этот угол (рис. 2.15, б, в); если он равен 90°, то значение Ѱ в соответствующем направлении равно нулю при любом расстоянии от ядра.
График радиального распределения вероятности для 2р-электрона (рис. 2.16) имеет вид, сходный с рис. 2.15, с той разницей, что вероятность обнаружения электрона на некотором расстоянии от ядра всегда положительна. Положение максимума на кривой распределения вероятности не зависит от выбора направления. Однако высота этого максимума зависит от направления: она наибольшая, когда радиус-вектор совпадает с направлением оси x, и убывает по мере отклонения радиуса-вектора от этого направления.
Такому распределению вероятности обнаружения 2р-электрона соответствует форма электронного облака, напоминающая двойную грушу или гантель (рис. 2.17).
Как видно, электронное облако сосредоточено вблизи оси х, а в плоскости yz, перпендикулярной этой оси. электронного облака нет; вероятность обнаружить здесь 2р-электрон равна нулю.
Рис. 2.17 приближенно передает форму электронного облака не только 2р- электронов, но также и р-электронов третьего и последующих слоев. Но графики радиального распределения вероятности имеют здесь более сложный характер: вместо одного максимума, изображенного в правой части рис. 2.16, на соответствующих кривых появляются два максимума (Зр-электрон), три максимума (4р-электрон) и т. д. При этом наибольший максимум располагается все дальше от ядра.
Еще более сложную форму имеют электронные облака d -электронов ( l = 2). Большинство из них представляют собой «четырехлепестковую» фигуру (рис. 2.18).
Если несколько электронов имеют одинаковые значения и главного, и орбитального квантовых чисел (комбинацию (n,l)), то говорят, что они относятся к одной электронной подоболочке, энергетическому подуровню, квантовому подслою:
(п; I) = const — электронная подоболочка, энергетический подуровень, квантовый подслой.
Исходя из значений п и l, возможны следующие типы электронных подоболочек:
1 s, 2 s, 2 р, 3 s, З р, 3 d, 4 s, 4 р, 4 d, 4 f, 5 s, 5 р, 5 d, 5 f, 5 g, 6 s, 6 p, 6 d,...

Орбитальное квантовое число влияет на энергию электронных подоболочек в многоэлектронных атомах.
Магнитное квантовое число. В предыдущих параграфах мы выяснили, что размеры и формы электронных облаков в атоме могут быть не любыми, а только такими, которые соответствуют возможным значениям квантовых чисел n и l. Из решения уравнения Шредингера для атома водорода следует, что и ориентация электронного облака в пространстве не может быть произвольной: она определяется значением третьего, так называемого магнитного квантового числа mi.
Магнитное квантовое число определяет возможные ориентации электронного облака в пространстве. Число таких ориентаций равно количеству возможных значений магнитного квантового числа, принимающего целочисленные значения, по модулю не превышающие значение орбитального квантового числа:
mi = -l,..., -2, -1, 0, +1, +2,..., + l.
Всего таких значений для конкретного значения орбитального квантового
числа 2 l + 1. Это означает, что число возможных ориентаций электронных облаков конкретной электронной подоболочки равно 2 l + 1. Таким образом, для разных значений l число возможных значений mi различно. Так, для s-электронов ( l = 0) возможно только одно значение mi ( mi = 0); для р-электронов ( l = 1) возможны три различных значения mi (—1, 0, +1); при l =2 (d-электроны) mi может принимать пять различных значений (—2, —1, 0, +1, +2), при l = 3 (f-электроны) mi может принимать семь различных значений (—3, —2, —1, О, +1,+2,+3).
Квантовое число mi получило название магнитного, поскольку от его значения зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. В отсутствие внешнего магнитного поля энергия электрона в атоме не зависит от значения mi. В этом случае электроны с одинаковыми значениями n и l, но с разными значениями mi обладают одинаковой энергией. Однако при действии на электрон внешнего магнитного поля энергия электрона в атоме изменяется, так что состояния электрона, различающиеся значением mi, различаются и по энергии. Это происходит потому, что энергия взаимодействия магнитного поля электрона с внешним магнитным полем зависит от величины магнитного квантового числа. Именно поэтому в магнитном поле происходит расщепление некоторых атомных спектральных линий: вместо одной линии в спектре атома появляются несколько (эффект Зеемана).
Волновая функция, описывающая состояние электрона в атоме, и полностью характеризуемая конкретными значениями квантовых чисел n, I и mi, называется пространственной атомной орбиталью или просто атомной орбиталъю. Для такой атомной орбитали принято сокращенное обозначение — АО, которым пользуются повсеместно при обсуждении свойств и строения атомов и молекул. Таким образом,
(n, I, mi)= const — атомная орбиталь, квантовая ячейка.
Симметрия атомных орбиталей. Поскольку s-состоянию (l = 0) соответствует единственное значение магнитного квантового числа (mi = 0), то любые возможные расположения s-электронного облака в пространстве идентичны. Действительно, математическая функция s-типа неизменна по отношению к следующим действиям, называемым операциями симметрии: вращению вокруг любой из осей и отражению в любой из плоскостей, проходящих через начало координат. Для нее также характерна неизменность по отношению к инверсии относительно начала координат (рис. 2.20).
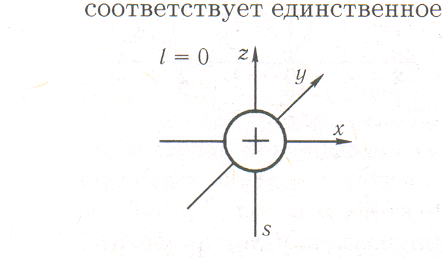 Все перечисленные операции преобразуют систему саму в себя и оставляют нетронутой по крайней мере одну точку. Поэтому они называются точечными операциями симметрии. Неизменность значений АО в любой точке пространства при преобразованиях (вращение вокруг оси, отражение относительно плоскости, инверсия относительно точки) называется
Все перечисленные операции преобразуют систему саму в себя и оставляют нетронутой по крайней мере одну точку. Поэтому они называются точечными операциями симметрии. Неизменность значений АО в любой точке пространства при преобразованиях (вращение вокруг оси, отражение относительно плоскости, инверсия относительно точки) называется
симметричностью функции. s-АО — симметричная функция, так как при любой из операций симметрии, переводящей точку r1 в точку r2, имеет место равенство:
Ѱ(r1)=Ѱ(r2).
На рис. 2.21 изображены АО р-симметрии. р-Орбитали характеризуются тремя различными значениями mi; в соответствии с этим они располагаются в пространстве тремя способами. При этом три р-электронных облака ориентированы во взаимно перпендикулярных направлениях, которые обычно принимают за направления координатных осей (x, у или z). Если АО ориентирована вдоль оси х, то она называется рx-орбиталью; соответственно определяются названия р y- и рz-орбиталей. Примечательно то, что при положительных значениях каждой из осей декартовой системы координат соответствующая р-АО положительна, а при отрицательных — отрицательна. Рассмотрим внимательнее отношение к операциям симметрии рx-АО.
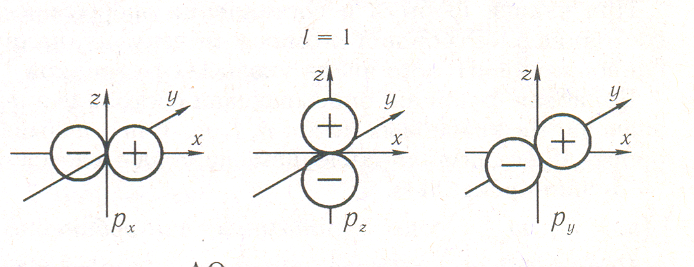
По отношению к вращению вокруг оси х АО симметрична, но по отношению к такой же операции симметрии вокруг оси у или z функция меняет знак. То есть в последнем случае АО совпадет со своим первоначальным изображением, если ее умножить на (—1). Значит, рx-АО симметрична по отношению к вращению вокруг оси х и антисимметрична по отношению к вращению вокруг оси у или z. Также видно, что рx-функция симметрична по отношению к отражению в любой из плоскостей, проходящих через ось x, и антисимметрична по отношению к отражению в плоскости уz. Данная орбиталь также антисимметрична к операции инверсии относительно начала координат.
Для d-орбиталей (l =2) возможно уже пять значений магнитного квантового числа и соответственно пять различных ориентации d-электронных облаков в пространстве (рис. 2.22).
/= 2
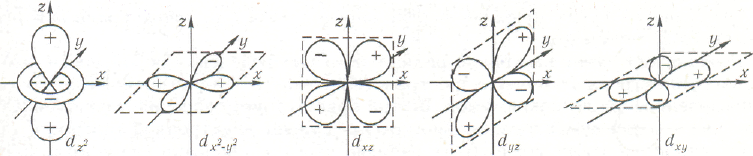
Названия (d-АО и их симметрия находятся в полном соответствии друг другу. Орбиталь с индексом ху ориентирована вдоль диагонали между осями х и у; знак ее в точке пространства с координатами (x, у, z) положителен, если произведение х • у положительно, и наоборот. Аналогично определяется ориентация и значность dxz, dyz-АО. Орбиталь dx2-y2 ориентирована вдоль осей х и у. Она положительна в точках пространства, располагающихся вдоль оси х (как и функция х2. имеющаяся в подстрочном индексе орбитали) и отрицательна вдоль оси у (как —у2). Функция dz2 всегда положительна в точках пространства, располагающихся вдоль оси z (подстрочный индекс z2 в таких точках положителен). Спиновое квантовое число. Теоретически было показано Дираком, а экспериментально подтверждено исследованиями атомных спектров, что помимо квантовых чисел n, l и mi, электрон характеризуется еще одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спинового квантового числа или просто спина (от английского spin — кручение, вращение); спин обычно обозначают буквой тs.
Спиновое квантовое число отражает наличие у электрона собственного момента движения. Проекция собственного момента количества движения электрона на избранное направление (например, на ось z и называется спином. Спиновое квантовое число принимает два значения:
тs = +1/2 или -1/2.
При записи формул и составлении энергетических диаграмм, отражающих состояние электронов в атомах и молекулах, наличие того или иного значения спинового квантового числа указывают стрелкой ↑ или ↓.
Волновая функция, описывающая состояние электрона в атоме конкретными значениями квантовых чисел n, l, mi и ms, называется спин-орбиталью. Спин-орбиталь с одним направлением спина называется α-спин-орбиталью, а с другим — β-спин-орбиталью.
( n,l,mi,ms ) = const — атомная спин-орбиталъ.
Например, Зрx-орбиталь со спином +1/2 может быть обозначена как Зрxα-спин-орбиталь, а 4s-орбиталь со спином — 1/2 тогда обозначают как 4sβ-спин-орбиталь.
Четыре квантовых числа — n, l, mi, ms — полностью определяют состояние электрона в атоме.
Date: 2015-09-18; view: 1214; Нарушение авторских прав