
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Модели строения атома
|
|
Одна из первых моделей строения атома была предложена Томсоном в 1903 г. Атом представлялся как «море положительного электричества» с колеблющимися в нем электронами. Суммарный отрицательный заряд электронов электронейтрального атома приравнивался его суммарному положительному заряду
Планетарная модель. Для проверки гипотезы Томсона и более точного определения строения атома Резерфорд провел серию опытов по рассеянию α-частиц тонкими металлическими пластинками — фольгой.
Источник а-излучения помещали в свинцовый кубик с просверленным в нем каналом, так что удавалось получить поток α-частиц, летящих в определенном направлении. Альфа-частицы являются двукратно ионизированными атомами гелия (Не2+). Они имеют положительный заряд +2 и массу, почти в 7350 раз превышающую массу электрона. Попадая на экран, покрытый сульфидом цинка, а-частицы вызывали его свечение, причем в лупу можно было увидеть и подсчитать отдельные вспышки, возникающие на экране при попадании на него каждой α-частицы. Между источником излучения и экраном помещали фольгу. По вспышкам на экране можно было судить о рассеянии α-частиц, т. е. об их отклонении от первоначального направления при прохождении через слой металла.
Оказалось, что большинство α-частиц проходит через фольгу, не изменяя своего направления, хотя толщина фольги соответствовала сотням тысяч атомных диаметров. Но некоторая доля α-частиц все же отклонялась на небольшие углы, а изредка α-частицы резко изменяли направление своего движения и даже (примерно 1 из 100000} отбрасывались назад, как бы натолкнувшись на массивное препятствие. Случаи такого резкого отклонения α-частиц можно было наблюдать, перемещая экран с лупой по дуге.
Из результатов этих опытов следовало, что подавляющая часть пространства, занимаемого атомом металла, не содержит тяжелых частиц — там могут размещаться только электроны. Ведь масса электрона почти гораздо меньше массы а-частицы, так что столкновение с электроном практически не может повлиять на направление движения а-частицы. Случаи же резкого отклонения и даже отбрасывания а-частиц означают, что в атоме есть какое-то тяжелое ядро, в котором сосредоточена преобладающая часть всей массы атома. Это ядро занимает очень маленький объем, — именно поэтому а-частицы так редко с ним сталкиваются, — и должно обладать положительным зарядом, который и вызывает отталкивание одноименно заряженных а-частиц.
Результаты опыта Резерфорд объяснил, предложив «планетарную» модель атома, уподоблявшую его солнечной системе. Согласно планетарной модели в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100000 раз меньше размеров самого атома. Это ядро заключает в себе почти всю массу атома и несет положительный заряд. Вокруг ядра движутся электроны, число которых определяется зарядом ядра. Внешняя траектория движения электронов определяет внешние размеры атома. Диаметр атома — величина порядка 10-8 см, а диаметр ядра — порядка 10-13—10-12 см.
Чем больше заряд атомного ядра, тем сильнее будет отталкиваться от него α-частица. тем чаще будут встречаться случаи сильных отклонений α-частиц, проходящих через слой металла, от первоначального направления движения. Поэтому опыты по рассеянию α-частиц дают возможность не только обнаружить существование атомного ядра, но и определить его заряд. Уже из опытов Резерфорда следовало, что заряд ядра (выраженный в единицах заряда электрона) численно равен порядковому номеру элемента в периодической системе.
Был установлен физический смысл порядкового номера элемента в периодической системе: порядковый номер оказался важнейшей константой элемента, выражающей положительный заряд ядра его атома. Из электронейтральности атома следует, что и число вращающихся вокруг ядра электронов равно порядковому номеру элемента.
Это открытие дало новое обоснование расположению элементов в периодической системе. Вместе с тем оно устраняло и кажущееся противоречие в системе Менделеева -— положение некоторых элементов с большей атомной массой впереди элементов с меньшей атомной массой (теллур и йод, аргон и калий, кобальт и никель). Оказалось, что противоречия здесь нет, так как место элемента в системе определяется зарядом атомного ядра. Было экспериментально установлено, что заряд ядра атома теллура равен 52, а атома йода — 53; поэтому теллур, несмотря на большую атомную массу, должен стоять до йода. Точно так же заряды ядер аргона и калия, никеля и кобальта полностью отвечают последовательности расположения этих элементов в системе.
Итак, заряд атомного ядра является той основной величиной, от которой зависят свойства элемента и его положение в периодической системе. Поэтому периодический закон Менделеева в настоящее время можно сформулировать следующим образом:
свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
Определение порядковых номеров элементов по зарядам ядер их атомов позволило установить общее число мест в периодической системе между водородом, имеющим порядковый номер 1, и ураном (порядковый номер 92), считавшимся в то время последним членом периодической системы элементов. Когда создавалась теория строения атома, оставались незанятыми места 43, 61, 72, 75, 85 и 87, что указывало на возможность существования еще неоткрытых элементов. И действительно, в 1922 г. был открыт элемент гафний, который занял место 72; затем в 1925 г.— рений, занявший место 75. Элементы, которые должны занять остальные четыре свободных места таблицы, оказались радиоактивными и в природе не найдены, однако их удалось получить искусственным путем. Новые элементы получили названия технеций (порядковый номер 43), прометий (61), астат (85) и франций (87). В настоящее время все клетки периодической системы между водородом и ураном заполнены. Однако сама периодическая система не является завершенной.
Атомные спектры. Планетарная модель была крупным шагом в теории строения атома. Однако в некоторых отношениях она противоречила твердо установленным фактам. Отметим два таких противоречия.
Во-первых, теория Резерфорда не могла объяснить устойчивости атома. Электрон, вращающийся вокруг положительно заряженного ядра, должен, подобно колеблющемуся электрическому заряду, испускать электромагнитную энергию в виде световых волн. Но, излучая свет, электрон теряет часть своей энергии, что приводит к нарушению равновесия между центробежной силой, связанной с вращением электрона, и силой электростатического притяжения электрона к ядру. Для восстановления равновесия электрон должен переместиться ближе к ядру. Таким образом, электрон, непрерывно излучая электромагнитную энергию и двигаясь по спирали, будет приближаться к ядру. Исчерпав всю свою энергию, он должен «упасть» на ядро, и атом прекратит свое существование. Этот вывод противоречит реальным свойствам атомов, которые представляют собой устойчивые образования, и могут существовать, не разрушаясь, чрезвычайно долго.
Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Напомним, что при пропускании через стеклянную или кварцевую призму света, испускаемого раскаленным твердым или жидким телом, на экране, поставленном за призмой, наблюдается так называемый сплошной спектр, видимая часть которого представляет собой цветную полосу, содержащую все цвета радуги. Это явление объясняется тем, что излучение раскаленного твердого или жидкого тела состоит из электромагнитных волн всевозможных частот. Волны различной частоты неодинаково преломляются призмой и попадают на разные места экрана. Совокупность частот электромагнитного излучения, испускаемого веществом, и называется спектром испускания. С другой стороны, вещества поглощают излучение определенных частот. Совокупность последних называется спектром поглощения, вещества.
Для получения спектра вместо призмы можно воспользоваться дифракционной решеткой. Последняя представляет собой стеклянную пластинку, на поверхности которой на очень близком расстоянии друг от друга нанесены тонкие параллельные штрихи (до 1500 штрихов на 1 мм). Проходя сквозь такую решетку, свет разлагается и образует спектр, аналогичный полученному при помощи призмы. Дифракция присуща всякому волновому движению и служит одним из основных доказательств волновой природы света.
Излучение, испускаемое твердыми телами или жидкостями, всегда дает сплошной спектр. Излучение, испускаемое раскаленными газами и парами, в отличие от излучения твердых тел и жидкостей, содержит только определенные длины волн. Поэтому вместо сплошной полосы на экране получается ряд отдельных цветных линий, разделенных темными промежутками. Число и расположение этих линий зависят от природы раскаленного газа или пара. Так, пары калия дают спектр, состоящий из трех линий, — двух красных и одной фиолетовой; в спектре паров кальция несколько красных, желтых и зеленых линий и т. д.
Такие спектры называются линейчатыми. Было установлено, что свет, испускаемый атомами газов, имеет линейчатый спектр, в котором спектральные линии могут быть объединены в серии.
В каждой серии расположение линий соответствует определенной закономерности.
Тот факт, что атомы каждого элемента дают вполне определенный, присущий только этому элементу спектр, причем интенсивность соответствующих спектральных линий тем выше, чем больше содержание элемента во взятой пробе, широко применяется для определения качественного и количественного состава веществ и материалов. Этот метод исследования называется спектральным анализом.
Планетарная модель строения атома оказалась неспособной объяснить линейчатый спектр испускания атомов водорода и тем более объединение линий спектра в серии. Как было указано выше, электрон, вращающийся вокруг ядра, должен приближаться к ядру, непрерывно меняя скорость своего движения. Частота испускаемого им света определяется частотой его вращения и, следовательно, должна непрерывно меняться. Это означает, что спектр излучения атома должен быть непрерывным, сплошным. Таким образом, теория Резерфорда не смогла объяснить ни существования устойчивых атомов, ни наличия у них линейчатых спектров.
Существенный шаг в развитии представлений о строении атома сделал в 1913 г. Нильс Бор, предложивший теорию, объединяющую планетарную модель атома с квантовой теорией света.
Квантовая теория света. В 1900 г. М. Планк показал, что способность нагретого тела к лучеиспусканию можно правильно количественно описать, только предположив, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно, т. е. отдельными порциями — квантами. При этом энергия Е каждой такой порции связана с частотой излучения соотношением. получившим название уравнения Планка: Е=h×ѵ
где h, — постоянная Планка, универсальная константа, равная 6,626×10-34 Дж×с. Сам Планк долгое время полагал, что испускание и поглощение света квантами есть свойство излучающих тел, а не самого излучения, которое способно иметь любую энергию и поэтому могло бы поглощаться непрерывно. Однако в 1905 г. Эйнштейн, анализируя явление фотоэлектрического эффекта, пришел к выводу, что электромагнитная (лучистая) энергия существует только в форме квантов и что, следовательно, излучение представляет собой поток неделимых материальных «частиц» (фотонов), энергия которых определяется уравнением Планка.
| Схема установки для наблюдения фотоэлектрического эффекта: М — пластинка испытуемого металла; С —• металлическая сетка; Б -- источник постоянного электрического напряжения; Г -— гальванометр. |
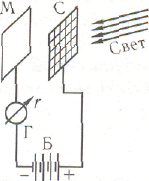
Фотоэлектрическим эффектом называется испускание металлом электронов под действием падающего на него света. Это явление было подробно изучено в 1888—1890 гг. А. Г. Столетовым. Схема установки для измерения фотоэффекта изображена на рис.. Если поместить установку в вакуум и подать на пластинку М отрицательный потенциал, то тока в цепи наблюдаться не будет, поскольку в пространстве между пластинкой и сеткой нет заряженных частиц, способных переносить электрический ток. Но при освещении пластинки источником света гальванометр обнаруживает возникновение тока (называемого фототоком), носителями которого служат электроны, вырываемые светом из металла.
Оказалось, что при изменении интенсивности освещения изменяется только число испускаемых металлом электронов, т. е. сила фототока. Но максимальная кинетическая энергия каждого вылетевшего из металла электрона не зависит от интенсивности освещения, а изменяется только при изменении частоты падающего на металл света. Именно с увеличением длины волны (т. с. с уменьшением частоты(длина волны света λ и его частота ѵ связаны соотношением λ × ѵ = C, где С — скорость света)) энергия испускаемых металлом электронов уменьшается, а затем, при определенной для каждого металла длине волны, фотоэффект исчезает и не проявляется даже при очень высокой интенсивности освещения. Так, при освещении красным или оранжевым светом натрий не проявляет фотоэффекта и начинает испускать электроны только при длине волны, меньшей 590 нм (желтый свет); у лития фотоэффект обнаруживается при еще меньших длинах волн, начиная с 516 нм (зеленый свет); а вырывание электронов из платины под действием видимого света вообще не происходит и начинается только при облучении платины ультрафиолетовыми лучами.
Эти свойства фотоэлектрического эффекта совершенно необъяснимы с позиций классической волновой теории света, согласно которой эффект должен определяться (для данного металла) только количеством энергии, поглощаемой поверхностью металла в единицу времени, но не должен зависеть от типа излучения, падающего на металл. Однако эти же свойства получают простое и убедительное объяснение, если считать, что излучение состоит из отдельных порций, фотонов, обладающих вполне определенной энергией.
В самом деле, электрон в металле связан с атомами металла, так что для его вырывания необходима затрата определенной энергии. Если фотон обладает нужным запасом энергии (а энергия фотона определяется частотой излучения!), то электрон будет вырван, фотоэффект будет наблюдаться. В процессе взаимодействия с металлом фотон полностью отдает свою энергию электрону, потому что дробиться на части фотон не может. Энергия фотона будет частично израсходована на разрыв связи электрона с металлом, частично на сообщение электрону кинетической энергии движения. Поэтому максимальная кинетическая энергия выбитого из металла электрона не может быть больше разности между энергией фотона и энергией связи электрона с атомами металла. Следовательно, при увеличении числа фотонов, падающих на поверхность металла в единицу времени (т. е. при повышении интенсивности освещения), будет увеличиваться только число вырываемых из металла электронов, что приведет к возрастанию фототока, но энергия каждого электрона возрастать не будет. Если же энергия фотона меньше минимальной энергии, необходимой для вырывания электрона, фотоэффект не будет наблюдаться при любом числе падающих на металл фотонов, т. е. при любой интенсивности освещения.
Квантовая теория света, развитая Эйнштейном, смогла объяснить не только свойства фотоэлектрического эффекта, но и закономерности химического действия света, температурную зависимость теплоемкости твердых тел и ряд других явлений. Она оказалась чрезвычайно полезной и в развитии представлений о строении атомов и молекул.
Из квантовой теории света следует, что фотон неспособен дробиться: он взаимодействует как целое с электроном металла, выбивая его из пластинки; как целое он взаимодействует и со светочувствительным веществом фотографической пленки, вызывая ее потемнение в определенной точке, и т. д. В этом смысле фотон ведет себя подобно частице, т. е. проявляет корпускулярные свойства. Однако фотон обладает и волновыми свойствами: это проявляется в волновом характере распространения света, в способности фотона к интерференции и дифракции. Фотон отличается от частицы в классическом понимании этого термина тем, что его точное положение в пространстве, как и точное положение любой волны, не может быть указано. Но он отличается и от «классической» волны — неспособностью делиться на части. Объединяя в себе корпускулярные и волновые свойства, фотон не является, строго говоря, ни частицей, ни волной — ему присуща корпускулярно-волновая двойственность.
Строение электронной оболочки атома по Бору. Как уже указывалось, в своей теории Н. Бор исходил из планетарной модели атома. Основываясь на положении квантовой теории света о прерывистой, дискретной природе излучения и на линейчатом характере атомных спектров, он сделал вывод, что энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т. е. дискретно. Поэтому в атоме возможны не любые энергетические состояния электронов, а лишь определенные, «разрешенные» состояния. Иначе говоря, энергетические состояния электронов в атоме квантованы. Переход из одного разрешенного состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения.
Основные положения своей теории Бор сформулировал в виде постулатов (постулат —- утверждение, принимаемое без доказательства), содержание которых сводится к следующему:
1. Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарных,
2. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3. Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Последнее утверждение требует некоторых пояснений. Энергия электрона, вращающегося вокруг ядра, зависит от радиуса орбиты. Наименьшей энергией электрон обладает, находясь на ближайшей к ядру орбите (это так называемое нормальное состояние атома). Для того чтобы перевести электрон на более удаленную от ядра орбиту, нужно преодолеть притяжение электрона к положительно заряженному ядру, что требует затраты энергии. Этот процесс осуществляется при поглощении кванта света. Соответственно, энергия атома при таком переходе увеличится, он перейдет в возбужденное состояние. Переход электрона в обратном направлении, т. е. с более удаленной орбиты на более близкую к ядру, приведет к уменьшению энергии атома; освободившаяся энергия будет выделена в виде кванта электромагнитного излучения. Если обозначить начальную энергию атома при нахождении электрона на более удаленной от ядра орбите через Ен, а конечную энергию атома для более близкой к ядру орбиты через Е к, то энергия кванта, излучаемого при перескоке электрона, выразится разностью: Е = Ен — Ек. Принимая во внимание уравнение Планка Е = h×ѵ, получим h×ѵ = Е н — ЕК, откуда ѵ = (Ен — ЕК)/ h.
Последнее уравнение позволяет вычислить возможные частоты (или длины волн) излучения, способного испускаться или поглощаться атомом, т. е. рассчитать спектр атома.
Постулаты Бора находились в резком противоречии с положениями классической физики. С точки зрения классической механики электрон может вращаться по любым орбитам, а классическая электродинамика не допускает движения заряженной частицы по круговой орбите без излучения. Но эти постулаты нашли своё оправдание в замечательных результатах, полученных Бором при расчете спектра атома водорода.
Здесь следует отметить, что работа Бора появилась в то время (1913 г.), когда атомные спектры многих элементов были изучены и спектральный анализ нашел уже обширные применения. Так, с помощью спектрального анализа были открыты благородные газы, причем гелий был сначала обнаружен в спектре Солнца и только позже — на Земле. Было ясно, что атомные спектры представляют собой своеобразные «паспорта» элементов. Однако язык этих «паспортов» оставался непонятным; были установленылишь некоторые эмпирические правила, которые описывали расположение линий в атомных спектрах.
Теория Бора объяснила физическую природу атомных спектров как результата перехода атомных электронов с одних стационарных орбит на другие.
Бор не ограничился объяснением уже известных свойств спектра водорода, но на основе своей теории предсказал существование и местоположение неизвестных в то время спектральных серий водорода, находящихся в ультрафиолетовой и инфракрасной областях спектра и связанных с переходом электрона на ближайшую к ядру орби т у и на орбиты, более удаленные от ядра, чем вторая. Все эти спектральные серии были впоследствии экспериментально обнаружены в замечательном согласии с расчетами Бора.
Однако теория страдала внутренней противоречивостью, которую прекрасно сознавал сам Бор: наряду с постулатами, противоречившими законам механики и электродинамики, в теории Бора эти законы использовались для расчета сил, действующих на электрон в атоме. Оставался неясным и ряд вопросов, связанных с самими постулатами Бора, например, где находится электрон в процессе перехода с одной орбиты на другую? Как вытекает из теории относительности, ни один физический процесс не может распространяться со скоростью, превышающей скорость света. Поэтому переход электрона на новую орбиту, отделенную некоторым расстоянием от исходной, не совершается мгновенно, а длится некоторое время. В течение этого времени электрон должен находиться где-то между исходной и конечной орбитами. Но как раз такие промежуточные состояния «запрещаются» теорией, поскольку постулируется возможность пребывания электрона только на стационарных орбитах.
Наконец, несмотря на усовершенствования, внесенные в теорию Бора другими учеными (была принята во внимание возможность движения электрона в атоме не только по круговым, но и по эллиптическим орбитам, по-разному расположенным в пространстве), эта теория не смогла объяснить некоторых важных спектральных характеристик многоэлектронных атомов и даже атома водорода. Например, оставалась неясной причина различной интенсивности линий в атомном спектре водорода; не объяснялась тонкая структура спектров атомов, заключающаяся в том, что их отдельные линии расщепляются на несколько других. Сами количественные расчеты многоэлектронных атомов оказались чрезвычайно сложными и практически неосуществимыми. Теория ошибочно описывала магнитные свойства атома водорода, принципиально не могла объяснить образование химической связи в молекулах.
Все же теория Бора была важным этапом в развитии представлений о строении атома; как и гипотеза Планка— Эйнштейна о световых квантах (фотонах), она показала, что нельзя автоматически распространять законы природы, справедливые для больших тел - — объектов макромира, на ничтожно малые объекты микромира — атомы, электроны, фотоны. Поэтому и возникла задача разработки новой физической теории, пригодной для непротиворечивого описания свойств и поведения объектов микромира. При этом в случае макроскопических тел выводы этой теории должны совпадать с выводами классической механики и электродинамики (так называемый принцип соответствия, выдвинутый Бором).
Эта задача была решена в 20-х годах XX века, после возникновения и развития новой отрасли теоретической физики — квантовой или волновой механики.
Вскоре было установлено, что представление об электроне как частице, подчиняющейся законам классической механики, является ошибочным.
В 1924 г. Луи де Бройлъ распространил идею о двойственности природы света на вещество, предположив, что поток материальных частиц должен обладать и волновыми свойствами, однозначно связанными с массой и энергией. Иными словами, движение частицы было сопоставлено с распространением волны.
Корпускулярные свойства электрона выражаются в его способности проявлять свое действие только как целого. Волновые свойства электрона проявляются в особенностях его движения, в дифракции и интерференции электронов. Когда мы говорим, что электрон, помимо корпускулярных, обладает и волновыми свойствами, то подразумеваем, что движение электронов описывается как процесс корпускулярный и волновой.
Создание квантовой механики произошло на пути обобщения представления о корпускулярно-волновой двойственности фотона на все объекты микромираи прежде всего на электроны.
Расстояние между узлами кристаллической решетки различных соединений, между соседними атомами в большинстве молекул и размеры самих атомов соизмеримы с величиной длины волны. Таким образом, электрон в атоме и молекуле обладает как свойствами частицы, так и волновыми свойствами. Частицы, размеры которых соизмеримы с их длиной волны или меньше, называются микрочастицами или микрообъектами. Частицы больших размеров относят к макрообъектам. Правильное описание движения электрона (микрочастицы) в атоме должно учитывать его двойственный характер. Это невозможно в рамках классической механики Ньютона, но оказывается возможным с помощью более общей механики — квантовой (волновой).
В классической механике для определения траектории движения и скорости частицы требуется знание начального импульса и пространственных координат ее положения. Однако в квантовой механике доказывается, что существует ограничение на точность одновременного определения этих величин. Это ограничение получило название соотношения неопределенностей
Δp × Δx ≥ 1,
где Δp и Δx —• неопределенность (погрешность) в определении импульса и координаты частицы, соответственно. Согласно соотношению неопределенностей нельзя одновременно вполне точно измерить импульс и координату электрона в атоме. Если бы удалось измерить координату частицы так точно, что Δx = О, то ошибка в измерении импульса стала бы бесконечно большой. В связи с этим в квантовой механике состояние микрочастицы полностью описывается не ее координатой и скоростью, а некоторой функцией. Эта функция носит вероятностный характер и обозначается греческой буквой «пси» Ѱ. Функция Ѱ, описывающая состояние электрона в атоме или молекуле и являющаяся обычной математической функцией, часто называется волновой функцией или орбиталью. Волновая функция, подобно амплитуде любого волнового процесса, может принимать как положительные, так и отрицательные значения.
Ѱ -— орбиталъ, математическая функция.
Величина Ѱ2 всегда положительна. При этом она обладает важным свойством: чем больше ее значение в данной области пространства, тем выше вероятность того, что электрон проявит здесь свое действие, т. е. что его существование будет обнаружено в каком-либо физическом процессе. Более точным будет следующее утверждение; вероятность обнаружения электрона в некотором малом объеме ΔV выражается произведением Ѱ2 × ΔV. Таким образом, сама величина Ѱ2 выражает плотность вероятности нахождения электрона в соответствующей области пространства.
Ѱ2 × ΔV — мера вероятности нахождения электрона в элементе пространства ΔV.
Вероятностью называется значение некоторой действительной функции, которое представляет собой результат опыта или наблюдения. Практически понятие вероятности проявляется в том, что относительная частота случайного события в независимых повторных испытаниях приближается к соответствующей вероятности. Поясним эти понятия на конкретном примере. Возьмем кубик, который имеет одну грань черную, а остальные пять — белые. Здесь действительной функцией является число граней определенного цвета. Если бросать такой кубик большое число раз, то можно подсчитать, что сверху белые грани оказываются в 5 раз чаще, чем черная. При числе испытаний (бросков) N черная грань появится приблизительно (1/6)N раз, а белые — (5/б)N раз. Относительная частота появления черной грани будет приблизительно равна 1/6, а вероятность ее появления равна в точности 1/6. Аналогично, вероятность появления сверху белой грани кубика равна 5/6.
Для уяснения физического смысла квадрата волновой функции рассмотрим рис. (показать рисунок), на котором изображен некоторый объем вблизи ядра атома водорода.
Плотность размещения точек на рис. пропорциональна значению Ѱ2 в соответствующем месте: чем больше величина Ѱ2, тем гуще расположены точки. Если бы электрон обладал свойствами материальной точки, то рис. можно было бы получить, многократно наблюдая атом водорода и каждый раз отмечая местонахождение электрона; плотность размещения точек на рисунке была бы тем больше, чем чаще обнаруживается электрон в соответствующей области пространства или, иначе говоря, чем больше вероятность обнаружения его в этой области. Мы знаем, однако, что представление об электроне как о материальной точке не соответствует его истинной физической природе. Поэтому рис. правильнее рассматривать как схематическое изображение электрона, «размазанного» по всему объему атома в виде так называемого электронного облака: чем плотнее расположены точки в том или ином месте, тем больше здесь плотность электронного облака. Иначе говоря, плотность электронного облака пропорциональна квадрату волновой функции. Представление о состоянии электрона как о некотором облаке электрического заряда оказывается удобным, хорошо передает основные особенности поведения электрона в атомах и молекулах и будет часто использоваться в последующем изложении. При этом, однако, следует иметь в виду, что электронное облако не имеет определенных, резко очерченных границ: даже на большом расстоянии от ядра существует некоторая. хотя и очень малая, вероятность обнаружения электрона. Поэтому под электронным облаком условно будем понимать область пространства вблизи ядра атома, в которой сосредоточена преобладающая часть (например,90%) заряда и массы электрона.
Date: 2015-09-18; view: 3014; Нарушение авторских прав