
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Работа при изменении объема газа
|
|
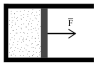
 Газ оказывает давление на любую стенку сосуда. Если стенка подвижна (например, поршень на рис. 1), то сила давления F совершит работу L, переместив поршень на расстояние Dk.
Газ оказывает давление на любую стенку сосуда. Если стенка подвижна (например, поршень на рис. 1), то сила давления F совершит работу L, переместив поршень на расстояние Dk.
Если Dk невелико, то давление газа останется примерно постоянным. Тогда работа будет равна:
L = P·F·Dk,
где F - площадь поршня,
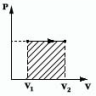
Произведение F·Dk равно изменению объема газа DV от начального V1 до конечного V2 значения, т.е. F·Dk =DV = V1 - V2. Тогда L = P·(V2 - V1) = P·DV.
В изобарном процессе расширения газа P = const. Следовательно, при любом сколь угодно большом увеличении объема сила давления газа на поршень будет постоянной, и формула работы сохранит свой вид
L = P·(V2 - V1).
Как видно из рисунка 2, работа газа при изобарном расширении равна площади под графиком процесса.
10. К каким системам относится понятие «распологаемая работа»? из чего складывается распологаемая работа?
Понятие располагаемая работа относится к открытым системам
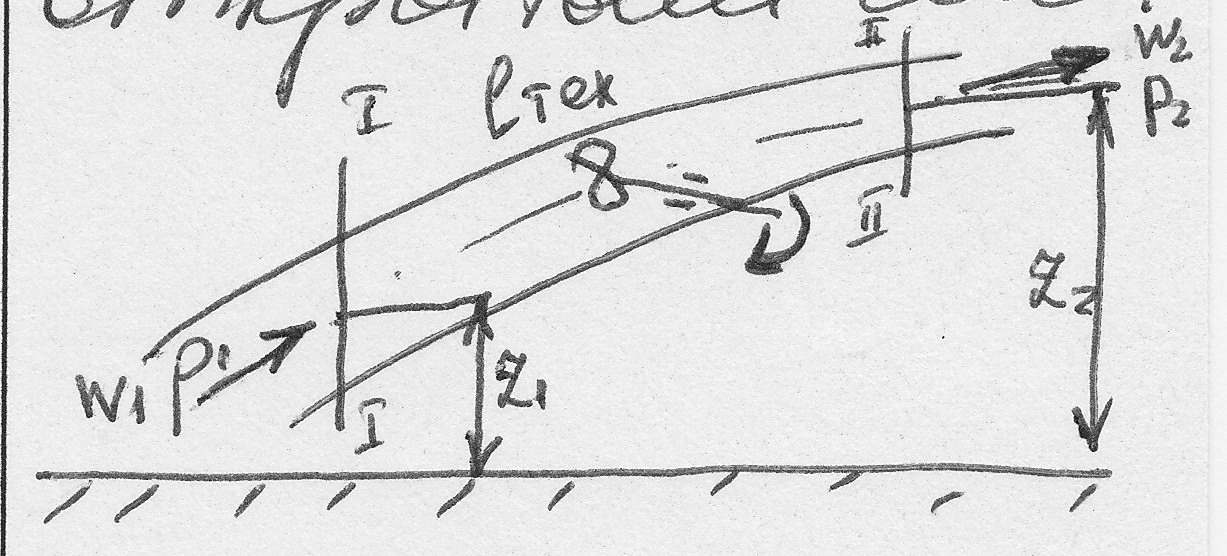
l0 - располагаемая работа складывается из изменения потенциальной, кинетической и технической работы: l=lk+ln+lтех; где lк=dw22/2 – dw12/2
Lп=g(z2-z1), dl0= dw2/2+gdz+dlтех
Располагаемая работа равна разности работы расширения и работы проталкивания dl0= dl- dlпрот
Работа проталкивания равна разности двух работ:
1) работа выхода – работа совершаемая системой по преодолению сопротивления окружающей среды, находящейся справа от сечения II-II.
2) работа ввода – работа совершаемая окружающей средой, находящейся слева от сечения I-I.
11. Политропный процесс – процесс, который совершается при постоянной теплоёмкости рабочего тела
pvn=const n – показатель полтропы n=(c-cp)/(c-cv) с – теплоёмкость конкретного процесса; cp – изобарная; cv – изохорная;
Изохорный процесс: с=cv, n=+-∞, (p^(1/n))v=const;
Изобарный процесс: с=cp, n=0, p=const;
Изотермический процесс: с=+-∞, n=1, pv=const;
Адиабатный процесс: с=0, n=cp/cv=k, p(v^k)=const;
Для 2-х точек политропного процесса можно записать соотношение p1v1n=pvn → p1/p=(v1/v)n
используя уравнение состояния идеального газа получим связь между другими параметрами состояния:
pv=RT, p1v1=RT1 → p/p1=Tv1/vT1
p/p1=Tv1/vT1=(v1/v)n → T/T1=(v1/v)n-1
Tvn-1=const T/T1=(p/p1)n-1/n
Получим связь между параметрами состояния изопроцессов:
Изохорный: v=const, T/T1=P/P1
Изобарный: T/T1=V/V1
Изотермический: P/P1=V1/V
Адиабатный: T/T1=(V1/V)^(k-1)=(P/P1)^(k-1/k)
12. В каком изопроцессе располагаемая работа равна работе изменения объёма? Св-ва pv-диаграммы. Почему в pv-координатах адиабата круче изотермы?
 В изотермическом.
В изотермическом.
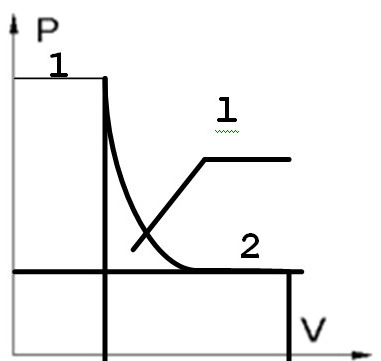
РV диаграмма и её свойства:
dl=pdν, l=∫pdν
В PV диаграмме работа расширений численно равна площади, заключённой между линией процесса и осью абсцисс dlo=∫νdp.
Располагаемая работа в PV диаграмме численно равна площади между линией процесса и осью ординат.
При обратимом адиабатном процессе идеального газа располагаемая рабо-та будет в к раз больше работы изменения объёма, а в изотермичес-ком процессе эти работы равны. На pv-диаграмме это отразится более крутым прохождением адиабаты.
13. Сформулируйте первый закон термодинамики и приведите его математическое выражение. Как выглядит первый закон термодинамики для открытых систем?
И зменение внутренней энергии системы равно сумме внешних энергетических воздействий на неё.
Мат. выражение: изменение удельной внутренней энергии термо-динамической системы равно алгебраической сумме полученной системой энергии в форме удельной теплоты δq и совершенной ею внешней удельной работой δl, или подведенная к рабочему телу энергия в форме удельной теплоты расходуется на изменение удельной внутренней энергии тела и на совершение телом внешней работы.
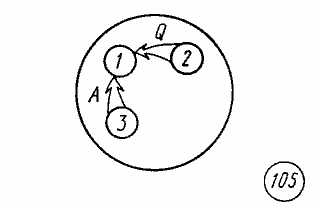 Первый закон термодинамики. Рассмотрим три тела — 1,2 и 3. Пусть между телом 1 и телом 2 осуществляется тепло-передача, а между телом 1 и телом 3 происходит механическое взаимодействие.
Первый закон термодинамики. Рассмотрим три тела — 1,2 и 3. Пусть между телом 1 и телом 2 осуществляется тепло-передача, а между телом 1 и телом 3 происходит механическое взаимодействие.
При теплопередаче количества теплоты Q внутренняя энергия тела 2 изменится на ΔU2=-Q, а внутренняя энергия тела 3 в результате совершения работы изменится на ΔU3=-A. В результате теплопередачи и механического взаимодействия внутренняя энергия каждого из трех тел изменится, но в изолированной термодинамической системе, в которую входят все три тела, по закону сохранения и превращения энергии внутренняя энергия U остается неизменной. Следовательно, сумма изменений внутренней энергии тел 1, 2 и 3 равна нулю: ΔU1+ΔU2+ΔU3=0. Отсюда изменение внутренней энергии тела 1 равно сумме изменений внутренней энергии взаимодействующих с ним тел 2 и 3, взятой с противоположным знаком: ΔU1=-ΔU2-ΔU2 или ΔU1=Q+A.
Так как тело 1 является неизолированной термодинамической системой, можно сделать общий вывод: в неизолированной термодинамической системе изменение внутренней энергии ΔU bравно сумме количества теплоты Q, переданного системе, и работы А внешних сил: ΔU=Q+A. Это выражение закона сохранения и превращения энергии называется первым законом термодинамики.
14. На что расходуется теплота, подводимая к рабочему телу, находящемуся в закрытом сосуде? Приведите формулы для изменения внутренней энергии и энтальпии идеального газа.
В изохорном процессе подведённая к системе теплота dq идёт на изменение внутренней энергии dU и совершение работы против внешних сил dL.
dq=dU+dL → dq=dU+pdν прибавим и отнимем vdp dq=dU+ pdv+ vdp -vdp получим (dh=dU+d(pv), d(pv)=vdp+pdv)dq=dh-vdp
dl0=-vdp → dq=dh+dl0
Изменение внутренней энергии идеального газа: ΔU=f(T2)-f(T1)
Изменение энтальпии является функцией температуры и не зависит от других параметров: h=U(T)+pv=U(T)+RT
Date: 2015-09-18; view: 1046; Нарушение авторских прав