
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплоемкость, определение, виды, уравнения связи
|
|
Отношение количества теплоты 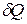 , полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела
, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела 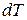 , называется теплоемкостью тела в данном процессе:
, называется теплоемкостью тела в данном процессе:
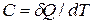 .
.
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают:
удельную массовую теплоемкость c, отнесенную к 1 кг газа,
Дж/(кг·К);
удельную объемную теплоемкость c´, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3·К);
удельную мольную теплоемкость 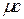 , отнесенную к одному киломолю, Дж/(кмоль·К).
, отнесенную к одному киломолю, Дж/(кмоль·К).
Зависимость между удельными теплоемкостями устанавливается очевидными соотношениями: 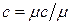 ;
; 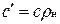
Здесь 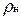 — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях.
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от +∞ до -∞.
В термодинамических расчетах большое значение имеют:
теплоемкость при постоянном давлении
 ,
,
равная отношению количества теплоты 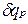 , сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
теплоемкость при постоянном объеме
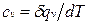 , (1.5)
, (1.5)
равная отношению количества теплоты, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела.
В соответствии с первым законом термодинамики для закрытых систем, в которых протекают равновесные процессы 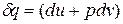 , и
, и
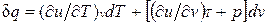 .
.
Для изохорного процесса (v =const) это уравнение принимает вид 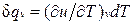 , и, учитывая (1.5), получаем, что
, и, учитывая (1.5), получаем, что
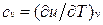 ,
,
т. е. теплоемкость тела при постоянном объеме равна частной производной от его внутренней энергии по температуре и характеризует темп роста внутренней энергии в изохорном процессе с увеличением температуры.
Для идеального газа 
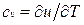
Для изобарного процесса () из уравнения (2.16) и (2.14) получаем
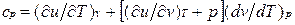
или
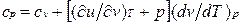
Это уравнение показывает связь между теплоемкостями ср и сv. Для идеального газа оно значительно упрощается. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому 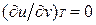 и, кроме того, из уравнения состояния следует
и, кроме того, из уравнения состояния следует 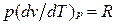 , откуда
, откуда
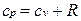 .
.
Это соотношение называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов.
В процессе v =const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы.
Для реальных газов 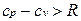 , поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
, поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kТ/2, приходящейся на одну степень свободы. Для 1 моля газа
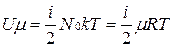 ,
,
где Nо — число Авогадро; i — число степеней свободы (число независимых координат, которые нужно задать для того, чтобы полностью определить положение молекулы в пространстве).
Поскольку для идеального газа 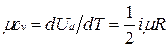 , то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
, то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
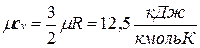 ;
; 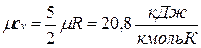 ;
; 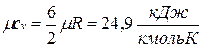 .
.
.
Теплоемкость реального газа зависит от давления, правда, очень слабо.
Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости.
Средней теплоемкостью с ср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:
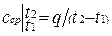
Выражение
 *
*
определяет теплоемкость при данной температуре или так называемую истинную теплоемкость. Из * следует, что
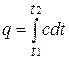
поэтому
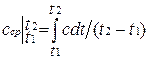 .
.
Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t.
11. Внутренняя энергия.
Внутренняя энергия системы включает в себя:
кинетическую энергию поступательного, вращательного и колебательного движения частиц;
потенциальную энергию взаимодействия частиц;
энергию электронных оболочек атомов;
внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности. Величина и=U/М, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
В дальнейшем для краткости будем называть величину и просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние:
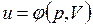 ;
; 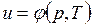 ;
; 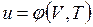 .
.
Ее изменение в термодинамическом процессе 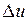 не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
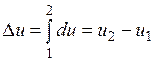 ;
;
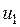 — значение внутренней энергии в начальном состоянии, а
— значение внутренней энергии в начальном состоянии, а 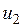 — в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
— в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
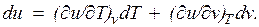
Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления 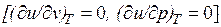 , а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
, а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
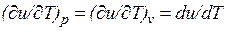
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление 610,8 Па, а для идеальных газов — при 0 °С вне зависимости от давления.
Date: 2015-09-18; view: 978; Нарушение авторских прав