
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга
|
|
При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. ΔΗ = ΤΔS. В этом случае соблюдается условие DGх.р=0, которое является термодинамическим условием химического равновесия.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями) веществ. В дальнейшем, равновесные концентрации обозначены символом вещества в квадратных скобках, например, [А]¸ [В], моль/дм3. Равновесное парциальное давление обозначено индексом р, например, ррА.
Для реакции, протекающей по уравнению:
аА(г) + bВ(г) ↔ cC(г)+ dD(г)
математическое выражение закона действующих масс может быть представлено в двух вариантах:
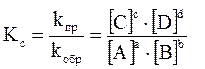 – аналитическая константа равновесия;
– аналитическая константа равновесия;
или
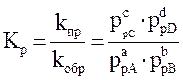 – термодинамическая константа равновесия.
– термодинамическая константа равновесия.
Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между Кр и Кс можно выразить уравнением
Кр = КС(RT)Δν,
где Δν – изменение числа молей газов в результате реакции
Δν = (с+d) – (а+b).
Термодинамическая константа может быть рассчитана, если известно стандартное значение энергии Гиббса:
lgКр = -DG0 /(2,303RT).
Как следует из вышесказанного, константа равновесия зависит от температуры. С учетом сущности понятия DG0 уравнение принимает вид
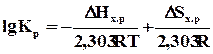 .
.
Если нет фазовых превращений компонентов реакции, то при увеличении температуры слагаемое 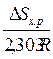 ≈const, тогда при возрастании температуры для экзотермической реакции (DН<0) константа равновесия уменьшается, а для эндотермической реакции (DН>0) – увеличивается.
≈const, тогда при возрастании температуры для экзотермической реакции (DН<0) константа равновесия уменьшается, а для эндотермической реакции (DН>0) – увеличивается.
Каждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют: 1) концентрация реагирующих веществ и продуктов реакции; 2) температура; 3) давление (для газов). При изменении любого из этих параметров равновесие может смещаться. Смещение равновесия определяется принципом Ле-Шателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению оказанного воздействия.
Принцип Ле-Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций одного или нескольких веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия.
Пример 3. Рассмотреть принцип Ле-Шателье на примере реакции получения водорода конверсией метана:
СН4 + 2Н2О(г) = СО2 + 4Н2 ΔΗ>0
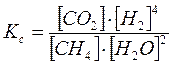 .
.
Date: 2015-09-18; view: 477; Нарушение авторских прав