
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Способы выражения состава
|
|
Раствором называется гомогенная система,состоящая из двух или нескольких компонентов, относительное содержание которых может меняться в широких пределах.
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями. Наиболее часто употребляются в химии следующие способы выражения состава раствора:
1. Массовая доля wi – процентное отношение массы растворенного вещества к общей массе раствора.
2. Мольная доля Ni – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе.
3. Молярная концентрация СМ или молярность М – отношение количества растворенного вещества к объему раствора.
4. Моляльная концентрация Сm или моляльность μ – отношение количества растворенного вещества к массе растворителя.
5. Эквивалентная концентрация СН или нормальность н – отношение числа эквивалентов растворенного вещества к объему раствора.
6. Титр Т – это масса растворенного вещества в 1 см3 раствора, г/ см3.
Пример 1. Какую массу воды нужно прибавить к 200 мл 15%-го раствора Н2SO4 (r=1,11 г/мл), чтобы получить 10% раствор? Какова нормальность исходного раствора?
Решение. масса 200 мл 15%-ного раствора Н2SO4 равна 200×1,11=222 г. В этом растворе содержится 15% Н2SO4 т.е. 222×0,15=33,3 г.
1. По условию задачи эта масса составит 10% от общей массы разбавленного раствора. Тогда масса полученного раствора будет равна
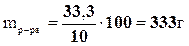 .
.
2. Следовательно, к исходному раствору необходимо добавить воды
mH2O = mр2-ра – m1 р-ра = 333-222=111г.
3. По определению, нормальность раствора равна количеству эквивалентов Н2SО4 в 1л раствора:
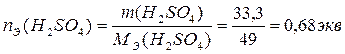 ,
,
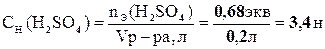 .
.
Таким образом, нормальность исходного раствора равна 3,4 экв/л.
Ответ: mН2О=111 г; СН=3,4 н.
пример 2. Рассчитать массу ВаСl2, содержащегося в 100 мл 0,3Н раствора. Какова массовая доля (%) и молярность этого раствора, если его плотность равна 1,05 г/мл?
Решение 1.В 100 мл 0,3н раствора ВаСl2 содержится 0,3×0,1=0,03 эквивалента ВаСl2. Эквивалентная масса ВаСl2 равна половине молярной массы, т.е. МЭ(ВаСl2) = 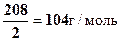 . Масса ВаСl2 в 100 мл 0,3 н раствора равна
. Масса ВаСl2 в 100 мл 0,3 н раствора равна
m(ВаСl2)=104×0,03=3,12 г.
2. Для нахождения массовой доли (%) найдем массу раствора:

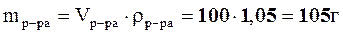 ,
, 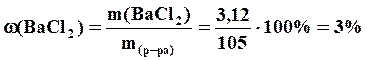

3. Молярность раствора равна количеству молей 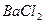 в 1л раствора. Количество вещества
в 1л раствора. Количество вещества 
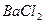 определяется из выражения
определяется из выражения 
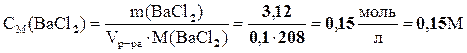
Ответ: m (ВаСl2) = 3,12 г; ω=3%, СМ=0,15 М.
Date: 2015-09-18; view: 521; Нарушение авторских прав