
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термохимия. Термохимия изучает тепловые эффекты химических процессов
|
|
Термохимия изучает тепловые эффекты химических процессов. Протекание химических реакций всегда связано с выделением или поглощением теплоты. Химические реакции, в результате которых выделяется теплота, называются экзотермическими, химические реакции, протекающие с поглощением теплоты, называются эндотермическими. При химических процессах может выделяться или поглощаться не только тепловая, но и другие виды энергии: электрическая, световая, механическая и др. Различные виды энергии, выделяемой или поглощаемой в ходе процесса, пересчитывают на тепловую энергию, выражая ее количество в килоджоулях (кДж).
Количество энергии относят к такому числу молей вещества, которое указано в уравнении реакции, и называют его тепловым эффектом (теплотой) Q реакции. Уравнения реакций, в которых указываются тепловые эффекты, называются термохимическими. Так как тепловой эффект зависит от состояния вещества, то в термохимических уравнениях указывают их фазовое состояние.
Для реакций, протекающих при постоянном давлении и постоянной температуре, тепловой эффект равен изменению энтальпии с противоположным знаком: Qр =-DН, кДж/моль, а при постоянном объеме он равен изменению внутренней энергии с противоположным знаком: QV =-D U.
Тепловой эффект реакции образования одного моля вещества из простых веществ называется теплотой образования DН данного вещества. Энтальпию образования 1 моля сложного вещества из простых веществ, измеренную при температуре 298 К и давлении 101,325 кПа, называют стандартной энтальпией образования 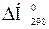 , кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
, кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
Термохимические расчеты осуществляют, применяя следствие из закона Гесса: тепловой эффект химической реакции DНх.р равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ, с учетом коэффициентов перед формулами этих веществ в реакции:
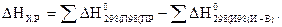 .
.
Пример 1. Вычислить тепловой эффект, написать термохимическое уравнение горения 1 моля метана и рассчитать количество теплоты, которое выделится при сгорании 10 л CH4.
Решение. Составим термохимическое уравнение реакции
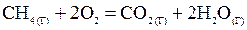
Выпишем стандартные теплоты образования 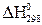 веществ (прил. 3):
веществ (прил. 3):
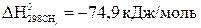 ,
,
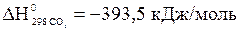 ,
,
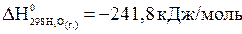 .
.
Тепловой эффект реакции вычислим, используя следствие закона Гесса:
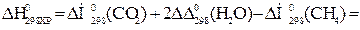
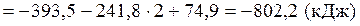
При сжигании 22,4 л выделяется 802,2 кДж, при сжигании 10 л выделяется х кДж. Составим и решим пропорцию:
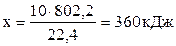 .
.
Ответ: 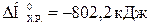 , при сжигании 10 л метана выделяется 360 кДж.
, при сжигании 10 л метана выделяется 360 кДж.
Date: 2015-09-18; view: 571; Нарушение авторских прав