
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая кинетика. Раздел химии, изучающий скорости и механизмы протекания реакций, называется химической кинетикой
|
|
Раздел химии, изучающий скорости и механизмы протекания реакций, называется химической кинетикой. При определении скоростей учитывается, что реакции могут быть гомогенными, то есть протекающими в гомогенной (однородной) системе, или гетерогенными, – протекающими в системах, состоящих более, чем из одной фазы.
На скорость реакции существенное влияние оказывают концентрации реагирующих веществ, давление в системе (для газовых реакций), температура, природа растворителя, наличие катализатора.
Зависимость скорости от концентрации реагирующих веществ описывается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, каждая из которых взята в степени, равной соответствующему стехиометрическому коэффициенту в уравнении реакции.
Для гомогенной реакции
аА(г) + bВ(г) = cC(г)+ dD(г),
υ=k [A]nа[B] nb,
где k – константа скорости химической реакции; nа и nb – коэффициенты, называемые порядками реакции по веществам А и В. Уравнение называется кинетическим уравнением химической реакции.
В гетерогенных системах реакция идет на поверхности раздела фаз, поэтому концентрация вещества, образующего твердую или жидкую фазу, остается постоянной и не влияет на скорость реакции. В связи с этим концентрации веществ, находящихся в конденсированном состоянии, не входят в выражение скорости реакции. Так, для реакции горения угля в кислороде
С(т) + О2(г) = СО2(г)
скорость горения может быть рассчитана по уравнению
υ=k [О2].
Сумма порядков реакции по реагентам называется порядком реакции n:
n = Σ ni,
где ni – порядок реакции по i-ому реагенту. Теоретически предсказать порядок реакции трудно, его определяют экспериментально. Порядок реакции зависит от ее сложности. Если реакция простая, т.е. протекает в одну стадию, то порядок реакции равен сумме стехиометрических коэффициентов
n = Σ νi,
где νi – коэффициент перед формулой i-го вещества в уравнении реакции (стехиометрический коэффициент).
Для многостадийных реакций порядки реакций по реагентам не совпадают со стехиометрическими коэффициентами, общий порядок не совпадает с суммой стехиометрических коэффициентов. Наиболее часто встречаются реакции первого, второго порядка. Вероятность протекания реакций третьего и более высокого порядков ничтожно мала. Некоторые реакции имеют дробный порядок.
Основной целью при изучении скорости реакции является вывод кинетического уравнения, т.е. определение константы скорости и порядка по каждому компоненту. Для этого экспериментально устанавливают зависимость концентрации компонента (с) от времени реакции (t) и графически обрабатывают полученные результаты, строя графики в координатах ln с=f(t) и 1/с =f(t). Та зависимость, которая оказалась линейной, и определяет порядок реакции. Для реакции первого порядка линейной является зависимость
ln с = ln с0 - k t.
Для реакции второго порядка линейна зависимость
1/с = 1/с0 + k t,
где с0 - начальная концентрация вещества.
Тангенс угла наклона прямой равен константе скорости (k).
Важной характеристикой реакции, зависящей от ее порядка, является период полупревращения t0,5 – время, необходимое, чтобы прореагировала половина взятого вещества. Для реакции первого порядка t0,5 определяют по формуле
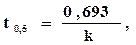
где k - константа скорости реакции.
Для реакции второго порядка t0,5 определяют по формуле
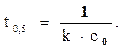
Пример 1. Во сколько раз изменится скорость прямой гомогенной одностадийной реакции А+В=С, если концентрацию вещества А увеличить в два раза, а концентрацию вещества В уменьшить в 4 раза.
Решение. Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс.
1. Согласно этому закону для гомогенной реакции А+В=С можно составить кинетическое уравнение: V1=k[A][B].
2. Обозначим концентрацию А через х, концентрацию В через у, тогда кинетическое уравнение реакции можно записать в виде V1=kxy.
3. Определим скорость реакции при увеличении концентрации А в 2 раза и одновременном уменьшении концентрации В в 4 раза:
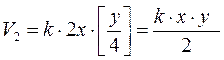 .
.
Находим отношение скоростей: 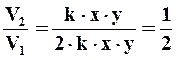 .
.
Таким образом, при изменении концентраций веществ, скорость уменьшается в 2 раза.
Ответ: V2 /V1 = 1/2.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому
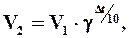
где V1-скорость реакции при температуре t1; V2 – скорость реакции при температуре t2; γ – температурный коэффициент, показывающий, во сколько раз увеличится скорость реакции при повышении температуры на каждые 10°; Δ t = t2 - t1. Скорость реакций быстро возрастает при повышении температуры за счет увеличения доли эффективных соударений, при которых общая энергия частиц достаточна для образования активированного комплекса. Константа скорости химической реакции зависит от доли эффективных соударений (уравнение Аррениуса):
k=Aе -(Еа/RТ),
где Еa – энергия активации, необходимая для перехода вещества в состояние активированного комплекса; R – универсальная газовая постоянная; Т- абсолютная температура; А – предэкспоненциальный множитель, пропорциональный общему количеству соударений. Предэкспоненциальный множитель отражает частоту столкновения и ориентацию реагирующих частиц.
Пример 2. Определите коэффициент γ для реакции, скорость которой увеличилась в 32 раза при увеличении температуры на 50 К.
Решение. Согласно правилу Вант-Гоффа V2/V1=γΔt/10, где V2/V1 – увеличение скорости реакции при повышении температуры на 50 К; Δt –собственно повышение температуры. Подставляя данные задачи, получаем:
32 = γ50/10= γ5. Таким образом, γ = 2, т.к. 25 = 32.
Ответ: γ = 2.
Пример 3. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 25ºС.
Решение. Обозначим энергию активации реакции без катализатора через Еа, а с катализатором – через Еа/; соответственно, константы скорости обозначим через k и k/. Используя уравнение Аррениуса, находим
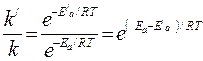 .
.
Отсюда
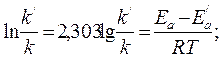
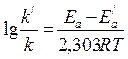 .
.
Подставляя в последнее уравнение данные задачи, выражая энергию активации в джоулях и учитывая, что Т = 298 К, получим
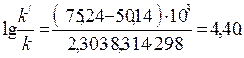
Окончательно находим k/k/ = 2,5·104. Таким образом, снижение энергии активации на 25,1 кДж привело к увеличению скорости реакции в 25 тысяч раз.
Date: 2015-09-18; view: 607; Нарушение авторских прав