
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение электронных оболочек
|
|
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:
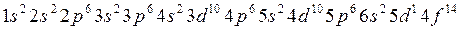
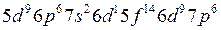 (2.3)
(2.3)
Пример 2. Сколько протонов и нейтронов содержат ядра изотопа 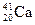 ? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам.
? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам.
Решение. 1. Количество протонов и нейтронов рассчитаем по формулам (2.1) и (2.2): 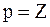 ,
, 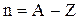 .
.
Здесь заряд ядра атома кальция Z = 20, атомная масса изотопа кальция А = 41. Получим Р = 20, n = 41-20 = 21.
2. Используя алгоритм распределения электронов по подуровням (2.3), составим электронную формулу атома кальция:
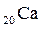
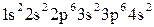 .
.
Так как последним заполняется s-подуровень, кальций относится к s-семейству.

 3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2
3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2
Пример 3. Какие значения квантовых чисел n, l, ml, ms имеют валентные электроны атома 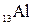 ? Напишите электронную формулу элемента.
? Напишите электронную формулу элемента.
Решение. 1. Электронную формулу атома алюминия составим согласно формуле (2.3):
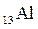
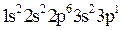 .
.
Известно, что валентными для s и p-элементов являются электроны внешнего слоя. Для атома алюминия это 3s23p1.
2. Состояние электрона в атоме описывается набором четырех квантовых чисел в виде групп символов nlx:
а) n - главное квантовое число, определяется по номеру заполненного уровня;
б) l - побочное (орбитальное) квантовое число. Для s-подуровня l=0; для р-подуровня l=1; для d-подуровня l=2 и т.д.; х - число электронов на этом подуровне;
в) m l– магнитное квантовое число, принимающее следующие значения: 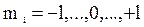 ;
;
г) m s - спиновое квантовое число, принимающее значения ±1/2.
| 13 Al | 3s2 | 3p1 | |||||||
| ¯ | | ||||||||
| n= | 3 3 |
-1
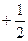
| |||||||
| l= | 0 0 | ||||||||
| ml = ms= | 0 0
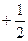 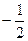
| ||||||||
Для определения квантовых чисел необходимо распределить валентные электроны по квантовым ячейкам: 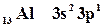
Date: 2015-09-18; view: 508; Нарушение авторских прав