
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Физико-химические процессы вакуумирования при ВПО. Термодинамика и кинетика дегазации стали. Технологические схемы. Основное оборудование
|
|
Контрольная работа №2
по предмету: «Электрометаллургия стали и спецэлектрометаллургия»
выполнил: Савченков Дмитрий Викторович
группа: МЧ-07-1д
преподаватель: Семин Александр Евгеньевич
Москва 2012г.
Физико-химические процессы вакуумирования при ВПО. Термодинамика и кинетика дегазации стали. Технологические схемы. Основное оборудование.
При вакуумировании происходят следующие процессы:
Углеродное раскисление в вакууме. Понижение давления в системе существенно влияет на развитие процессов, протекающих с образованием газовой фазы, в частности процесса окисления углерода.
Процессы дегазации. Из элементов, находящихся в обычных условиях при комнатной температуре в газообразном состоянии, в жидких стали растворены кислород, водород и азот.
Удаление кислорода из жидкой стали, содержащей элементы, которые понижают коэффициент активности кислорода, возможно при более низком давлении, но в практике внепечной обработки стали вакуумом не используются такое низкое давление
Удаление растворенных в стали газов при обработке вакуумом обусловлено уменьшением их парциального давления в атмосфере с уменьшением общего давления над металлом.
Растворимость водорода и азота в жидком железе по закону Сивертса
пропорциональна корню квадратному их парциального давления:
1/2H2=[H]; K = [H ] /p0,5Н2
1/2N2=[N]; K = [N]/ p0,5N2
Необходимо, однако, учитывать, что такое соотношение соблюдается лишь в том случае, когда двухатомный газ находится в растворе в виде простых частиц - атомов или ионов. При наличии химических связей между частицами растворенного газа и компонентами расплава наблюдаются отклонения от закона Сивертса. Поэтому соотношения, описываемые этим законом, в практике сталеплавильного производства справедливы лишь для водорода, а для азота, который может взаимодействовать с компонентами расплава, часто наблюдаются заметные отклонения от закона Сивертса. К тому же ряд элементов (Cr, V, Al), которые в жидкой стали не связывают азот в нитриды, понижают коэффициент активности азота, уменьшая возможность его удаления.
Удаление растворенных в металле водорода и азота возможно по трем механизмам: 1) образование газовых пузырьков в металле и их всплывание; 2) удаление (десорбция) с поверхности раздела металл-атмосфера; 3) образование пузырьков на межфазной твердой поверхности и их всплывание.
Как было показано при рассмотрении реакции окисления углерода, гомогенное зарождение пузырьков СО невозможно вследствие большого капиллярного давления. Еще менее вероятна возможность образования в жидком металле пузырьков водорода или азота, концентрация которых весьма мала. Как будет показано, она обычно недостаточна для преодоления даже одного ферростатического давления на глубине уже нескольких сантиметров. Поэтому первый из указанных механизмов не реализуется.
Процесс десорбции водорода и азота из жидкой стали можно представить состоящим из трех стадий:
1. Перенос растворенных в металле водорода и азота из объема к поверхности раздела с газовой фазой.
2. Адсорбция атомов водорода и азота в поверхностном слое жидкого металла: [H] = Hпов; [N] = Nпов.
3. Молизация адсорбированных атомов в молекулы и переход их в газовую фазу: 2Hпов = H2; 2Nпов=N2.
Скорость первой и второй стадий описывается уравнением первого порядка:
dCldτ = -k(FlV)(C-C пов ), (1)
где (C-Cпов) - градиент концентраций растворенного вещества равновесной в данный момент времени; k - константа скорости; F и V -соответственно поверхность и объем металла.
Скорость третьей стадии описывается уравнением второго порядка:
dC/dτ = F(k2C2 п ов -k 1 p), (2)
где k 1 и k2 - константы скорости прямой и обратной реакций; p -парциальное давление газа над расплавом.
Когда эта стадия является самой медленной, то C пов = C, так как
концентрации газа в объеме и на поверхности успевают выравниваться. Экспериментально установлено, что скорость удаления газов из металла описывается уравнением первого порядка. Следовательно, лимитирующей стадией рассматриваемого процесса является первая или вторая стадия. На основе закономерностей формальной кинетики трудно разделить влияние адсорбционных и диффузионных процессов. Даже влияние поверхностно-активных элементов (О, S) на процесс дегазации, используемый часто для оценки адсорбционной стадии, не является убедительным доводом в пользу этой стадии. Ведь поверхностное сгущение таких элементов вызывает уменьшение активной поверхности расплава, что согласно уравнению (2) приводит к замедлению переноса веществ. Поэтому по результатам экспериментальных данных принимают, что лимитирует процесс дегазации жидкого металла диффузионно-адсорбционная стадия, скорость которой описывается кинетическим уравнением (1). Интегрирование этого уравнения приводит к уравнению:
C = C р + (C 0- C р)exp(- kF V) τ, (3)
где C 0 - исходная концентрация (при τ = 0).
Как видно из уравнения (3), время τ дегазации стали до заданной концентрации примеси с данными исходной и равновесной ее концентрациями уменьшается с увеличением константы скорости k и величины относительной поверхности F/V. Константу скорости
можно увеличивать повышением интенсивности перемешивания, а относительную поверхность - уменьшением объема металла.
Образование пузырей на твердой межфазной поверхности (третий механизм) происходит при наличии на ней пор, размер которых должен быть достаточно велик для образования пузырька, имеющего радиус не менее критического, т.е. способного к самопроизвольному росту и, вместе с тем, достаточно мал, чтобы он не заполнялся жидким металлом. Первое из этих условий было рассмотрено при изучении реакции окисления углерода, второе определяется углом смачивания твердой поверхности жидким металлом.
Условия образования пузырьков газа на твердой поверхности показаны графически на рис. Они возможны в области левее сплошных линий 1-4, определяющих условие зарождения пузырьков, соответственно H2 или СО, не менее критического радиуса, и ниже штрих-пунктирных линий 5, 6, определяющих возможность наличия пор, не заполненных жидким металлом.
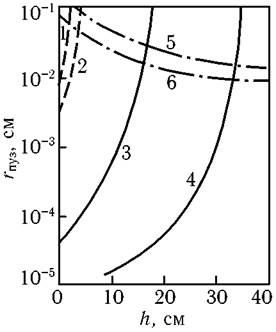 Рис. Зависимость радиуса пор при образовании пузырей в огнеупорной кладке от глубины ванны и равновесного содержания водорода в металле, %: 4 10–3 (1), 510–4 (2), или равновесного рСО (3 - 13 кПа, 4 - 26 кПа). Угол смачивания, град.: 10 (5), 60 (6)
Рис. Зависимость радиуса пор при образовании пузырей в огнеупорной кладке от глубины ванны и равновесного содержания водорода в металле, %: 4 10–3 (1), 510–4 (2), или равновесного рСО (3 - 13 кПа, 4 - 26 кПа). Угол смачивания, град.: 10 (5), 60 (6)
Как видно на рис., образование пузырьков водорода (кривые 1,2 и 5, 6) на твердой поверхности делается невозможным уже на глубине в несколько сантиметров. Пузырьки СО могут образовываться на глубине в десятки сантиметров (кривые 3, 4 и 5, 6).
Повышение интенсивности перемешивания металла способствует доставке реагентов к порам и отрыву пузырьков от твердой поверхности, что ускоряет процесс. Это же происходит при увеличении относительной поверхности контакта жидкой и твердой фаз, а также шероховатости последней.
Кроме трех перечисленных механизмов дегазации возможен еще один – переход газов из раствора (водород, азот) или вследствие химической реакции (СО) в готовые газовые пузырьки. Этот механизм в значительной мере реализуется при продувке жидкой стали аргоном.
Date: 2015-08-22; view: 1177; Нарушение авторских прав