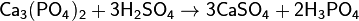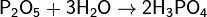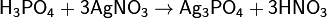Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реакции разложения нитратов при нагревании
|
|
1) Нитраты щелочных металлов разлагаются до нитритов: 2NaNO3 –t°® 2NaNO2 + O2
2) Нитраты менее активных металлов (от щелочноземельных до меди) разлагаются до оксидов: 2Mg(NO3)2 –t°® 2MgO + 4NO2 + O2 2Cu(NO3)2 –t°® 2CuO + 4NO2 + O2
3) Нитраты наименее активных металлов разлагаются до металлов:
Hg(NO3)2 –t°® Hg + 2NO2 + O2 2AgNO3 –t°® 2Ag + 2NO2 + O2
| 4) Нитрат аммония разлагаются до N2O NH4NO3 –t°® N2O + 2H2O | |||||||
Фосфор.
Р +15)2)8)5 1S22S22P63S23P3, фосфор: p– элемент, неметалл
АЛЛОТРОПИЯ ФОСФОРАВ свободном состоянии фосфор образует несколько аллотропных видоизменений:белый (мол.кр.реш), красный и чёрный фосфор (атомная решетка)
Красный фосфор практически нетоксичен. Белый фосфор очень ядовит,
ПОЛУЧЕНИЕ ФОСФОРА Ca3(PO4)2 + 5C + 3SiO2 →2 P + 5CO + CaSiO3.
Фосфорную кислоту получают из фосфата кальция:
Или взаимодействием с водой оксида фосфора(V),
H3PO4 — трёхосновная кислота средней силы. Качественная реакция с нитратом серебра — образуется жёлтый осадок:
|
Date: 2015-08-22; view: 600; Нарушение авторских прав