
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Влияние различных факторов на растворимость малорастворимых электролитов. Общие принципы растворения осадков малорастворимых электролитов
|
|
1) Природа растворяемого в-ва и растворителя. На растворимость влияют такие ф-ры: склонность в-ва к сольватации данным растворителем, способность растворенного в-ва изменять стр-ру р-ля, размер частиц осадка и т.д. Прис. орг. р-ля в водном р-ре обычно уменьшает растворимость малор. Электролитов.
2)температура. В целом у большинства малораств. Электролитов при пов. Температуры растворимость в воде увеличивается, что связано с поступлением доп. Энергии, компенсирующей энергию, необх. Для разрушения кристалл. Решетки.
3)ионная сила. Увел. Ионной силы р-ра приводит к пов. Растворимости(солевой эффект).
4)общий ион. Если к р-ру добавить нек. кол-во хорошо растворимого электролита, сод. тот же ион, что и малорастворимый электролит, то растворимость малораств. электролита уменьшится.
5)побочные р-ции. В рез-те побочных р-ций равновесие в с-ме «осадок-нас. р-р» смещается в сторону протекания процесса растворения, а значит, и при опр. условиях его можно будет практически полностью перевести в р-р.
Принципы. Частичное или полное растворение осадка может происх. при след. обстоятельствах: разбавлении р-ра, его нагревании, увел. Ионной силы и др. В юбщем случае условия растворения осадка будут зависеть от величины Кs осадка, а также св-в(Ка, бэта) того соединения, кот. обр. в рез-те его растворения.
24.Количественная оценка окисл.-восст. Способности в-в. …….
Для количественной оценки способности в-в отдавать и принимать электроны исп. электродные потенциалы.
Электродный потенциал- разность потенциалов, кот. возникли на границе «металл-р-р» в рез-те разделения зарядов.
Стандартный электродный потенциал полур-ции- это ЭДС гальванического элемента, сост. из нах. в станд. условиях электрода, на кот. протекает данная полур-ция, и стандартного водородного электрода. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
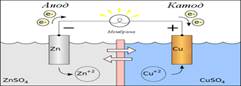 Схема гальванического элемента Даниэля-Якоби.
Схема гальванического элемента Даниэля-Якоби.
Стандартный водородный электрод пр.собой платиновую пластину, насыщенную водородом, кот.нах.в р-ре серной к-ты с а(Н+)=1.
Уравнение Нернста: 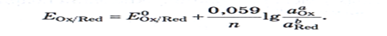
Уравнение Нернста описывает влияние активности компонентов, участв.в процессе, и температуры на величину потенциала.
Взаимосвязь между общей концентрацией в-ва в р-ре и активностью его формы:

Константа равновесия окисл.-восст. р-ции: 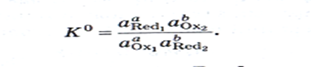 Взаимосвязь константы равновесия ОВР и ЭДС:
Взаимосвязь константы равновесия ОВР и ЭДС:
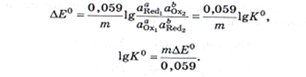
ОВР широко исп.в титриметрии, для обнаружения неорг. и орг. в-в,для маскировки мешающих ионов, во многих электрохим.и кинетических методах анализа. С ним связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. ОВР сопровождают круговорот веществ в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов, при электролизе и выплавке металлов другие ценные продукты.
ОВР лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах.
Формальный электродный потенциал. Влияние различных факторов(температура, посторонние ионы, рН, побочные реакции) на протекание ОВР. Использование ОВР для маскировки нежелательного влияния ионов.
Формальный электродный потенциал E Ox/Red0′ - это потенциал полуреакции, измеренный при условии, что концентрации окисленной и восстановленной формы равны 1 моль/л, а концентрации посторонних ионов известны.
Формальный электродный потенциал является аналогом условной концентрационной константы равновесия.
Величина формального потенциала зависит от ионной силы раствора, природы и концен-
трации посторонних электролитов. По величине форм электрод потенциала можно судить о протекании процессов комплексообразования, выпадения осадков.

Он равен выделенной полужирным шрифтом сумме первых трех членов в приведенном выше уравнении.
Date: 2015-08-15; view: 1147; Нарушение авторских прав