
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Общая х-ка и аналитические р-ии катионов 3 аналит. группы
|
|
К ней относ-ся Са,Sr,Ba.Не образ. КС.Групповой реагент- разбавленная серная кислота.Осадки сульфатов не раств-ся в кислотах и щелочах.Окрашивают пламя в жёлто-зелёный- Ba,в карминово-красный- Sr,в кирпично-красный- Са.
Реакция на ионы Кальция:
-с родизонатом натрия в щелочном р-ре даёт фиолетовое окрашивание.
-Ca2++CO32-=CaCo3(белый)
-Ca2++ C2O42- → CaC2O4↓
-С серной кислотой-белый осадок
Реакция на Стронций:
-с родизонатом натрия соединение красно-бурого цвета.
-Sr2++ С2O42- → SrС2O4↓(белый осадок)
- С серной кислотой-белый осадок
Реакция на Барий:
-2 CrO42- + 2Ba2+→ 2 BaCrO4↓(жёлтый)
-с родизонатом натрия соединения красного цвета.
- С серной кислотой-белый осадок
Вопрос 7. Катионы IV аналитической группы.
К IV группе принадлежат катионы Al3⁺, Zn2⁺, Cr3⁺, Sn2⁺, Sn4⁺, As3⁺, As5⁺. Образуют малорастворимые гидроксиды, фосфаты, карбонаты, сульфиды. Сульфиды и карбонаты алюминия и хрома при взаимодействии с водой образуют гидроксид металла и H2S (сульфиды) или CO2 (карбонаты). В водных растворах катионы данной группы, за исключением [Cr(H2O)6]3⁺, бесцветны. Гидратированные катионы четвёртой группы обладают выраженными кислотными свойствами. Образуют комплексные соединения, например, [Al(OH)4]¯. Ионы Al3⁺и Zn⁺ имеют постоянную степень окисления. Ионы Cr3⁺, Sn2⁺, Sn4⁺ могут участвовать в окислительно-восстановительных реакциях. Групповым реагентом является NaOH, в избытке которого гидроксиды катионов четвёртой аналитической группы, обладающие амфотерными свойствами, растворяются с образованием комплексных соединений типа [Al(OH)4]¯, [Cr(OH)4]¯, [Zn(OH)4]2¯.
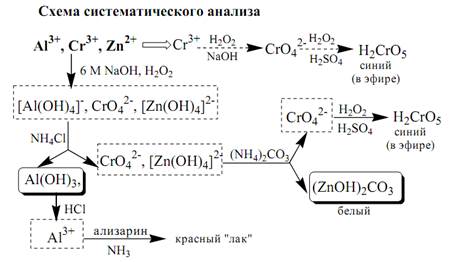
Вопрос 8. Катионы V аналитической группы.
К пятой аналитической группе относятся катионы Mg2⁺, Mn2⁺, Fe2⁺, Fe3⁺, Bi3⁺, Sb3⁺ и Sb5⁺. Образуют малорастворимые гидроксиды, карбонаты, сульфиды (кроме Mg2 ⁺), фосфаты. Растворы солей магния, висмута (III) и сурьмы (III, V) бесцветны. Растворы солей Fe(II) имеют бледно-зелёную окраску, Fe (III) - от жёлтой до коричневой и Mn (II) - бледно-розовую окраску. Разбавленные растворы солей Fe (II) и Mn (II) бесцветны. Ионы Fe2 ⁺, Fe3 ⁺, Bi3 ⁺, Sb (III) и Sb(V) способны образовывать комплексные соединения, например, [Fe(CN)6]3¯, Fe(CN)6]4¯, [SbCl6]3¯, [SbCl6], ¯ [BiI4]¯.Все катионы данной группы (кроме Mg2 ⁺) проявляют окислительно-восстановительные свойства: Fe,Bi, Sb (V) - окислители; Fe2 ⁺, Sb (III) - восстановители. Групповым реагентом является раствор NH3, от действия которого выпадают в осадок гидроксиды: белые Mg(OH)2, Mn(OH)2, Fe(OH)2, Bi(OH)3, Sb(OH)3, SbO(OH)3 и красно-бурый Fe(OH)3. Окраска Fe(OH)2 c течением времени изменяется до зелёной, а затем образуется красно-бурый Fe(OH)3. Осадки гидроксидов растворяются в кислотах и не растворяются в избытке щёлочи и аммиака.
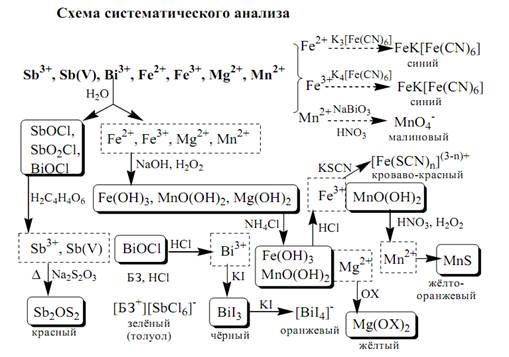
Вопрос 9. Катионы VI аналитической группы.
К шестой аналитической группе относятся катионы Cu2⁺, Co2⁺, Cd2⁺, Ni2⁺ и Hg2⁺. Образуют малорастворимые сульфиды, карбонаты, оксалаты, фосфаты, арсенаты, силикаты, хроматы, иодиды меди (I) и ртути (II). Большинство растворимых в воде солей окрашены: соли никеля - зелёные, кобальта - красные или розовые, меди - синие. Характерным свойством катионов VI группы является способность образовывать комплексные соединения, в том числе внутрикомплексные соединения с органическими реагентами. Все катионы VI аналитической группы, за исключением Cd2 ⁺,участвуют в реакциях окисления-восстановления. Ионы Hg2 ⁺ и Cu2 ⁺ проявляют себя как окислители, ионы Co2 ⁺ и Ni2 ⁺ - как восстановители. Групповым реагентом является раствор NH3. Гидроксиды катионов данной группы растворяются в избытке аммиака с образованием окрашенных аммиачных комплексов (катион тетраамминртути (II) и гексаамминкадмия (II) – бесцветные).
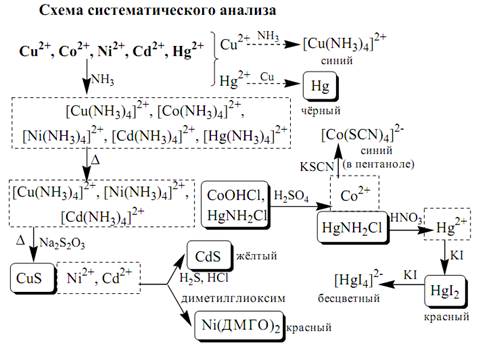
Вопрос 10. Систематический ход анализа катионов I- VI групп по кислотно-основной классификации.
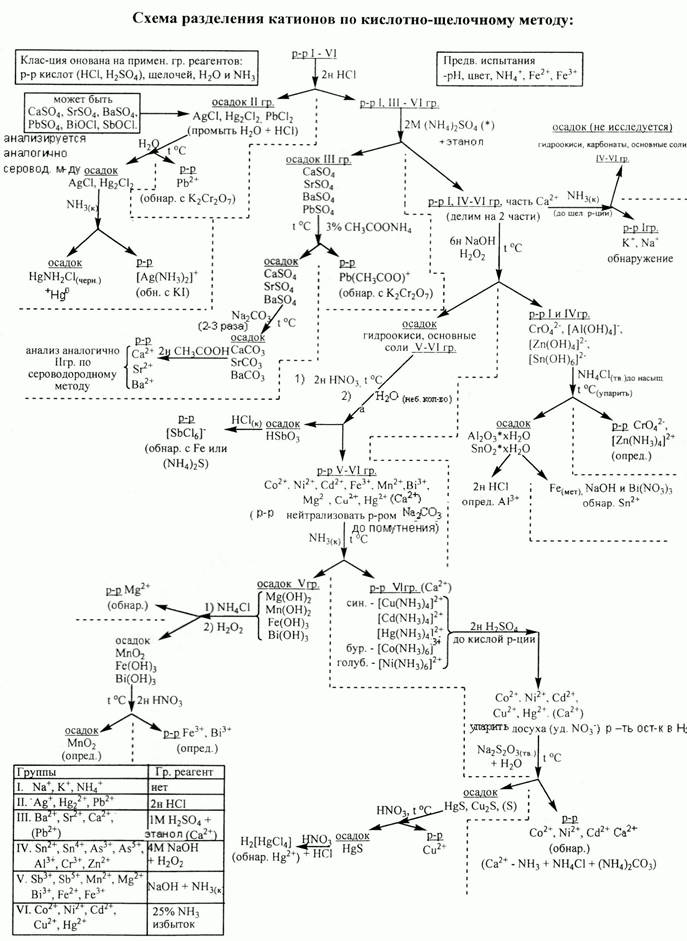

Вопрос 11. Общая характеристика, классификация и способы обнаружения анионов.
Реакции обнаружения анионов могут быть основаны на их окислительно-восстановительных свойствах, способности образовывать малорастворимые соединения, а также на взаимодействии с кислотами с образованием газообразных продуктов. Классификации анионов не являются строго установленными. Например, в зависимости от растворимости солей бария и серебра анионы разделяют на:

По окислительно-восстановительным свойствам анионы можно разделить на следующие группы:
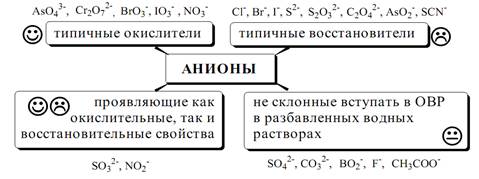
Обнаружение анионов целесообразно начинать с предварительных испытаний:
• установление рН раствора. Если среда кислая (рН<2), в ней не могут присутствовать анионы летучих и неустойчивых кислот (SO32¯, S2O32¯, CO32¯, NO2¯). Кроме того, в кислой среде в растворе не могут одновременно присутствовать анионы-окислители и анионы восстановители.
• испытание на выделение газообразных веществ под действием разбавленных кислот. Исследуемый раствор обрабатывают 1 М H2SO4. Выделение СО2 указывает на присутствие СО32¯, SО2 на SО32¯, NО2 на NО2 ¯, одновременно SО2 и осадка S на присутствие S2О32-. Выделение I2 говорит об одновременном присутствии I ¯и анионов-окислителей.
• испытание на присутствие анионов I группы. К исследуемому раствору добавляют раствор BaCl2 при рН 7-9. Отсутствие осадка S2О32¯ указывает на отсутствие анионов 1 группы, хотя BO2 образуют осадки с BaCl2 в концентрированных растворах.
• испытание на присутствие анионов II группы. К исследуемому раствору добавляют раствор AgNO3 в присутствии разбавленного раствора НNO3. Отсутствие осадка указывает на отсутствие анионов 2 группы.
• испытание на присутствие анионов-окислителей. К исследуемому раствору добавляют раствор KI в присутствии разбавленной H2SO4. Если при этом не выделяется I2, то анионы-окислители отсутствуют.
• испытание на присутствие анионов-восстановителей. К исследуемому раствору добавляют раствор KMnO4 в нейтральной среде и нагревают. Выпадение темно-бурого осадка указывает на присутствие анионов-восстановителей. Дополнительно можно проверить наличие сильных восстановителей по обесцвечиванию раствора I2. Далее проводят реакции обнаружения анионов, отсутствие которых не было доказано в предварительных испытаниях. Раствор, в котором проводят обнаружение, не должен содержать никаких катионов кроме K ⁺, Na ⁺,NH4 ⁺. Мешающие катионы удаляют путем кипячения с раствором Na2CO3 (готовят «содовую вытяжку»).
Вопрос 12. Анализ неизвестного неорганического вещества. Предварительные испытания. Переведение анализируемого вещества в раствор. Проведение анализа.
Анализ неизвестного вещества можно условно разделить на 3 этапа:
I. Предварительные испытания
II. Переведение анализируемого вещества в растворимое состояние
III. Обнаружение катионов и анионов
Твердый образец измельчают и делят на 4 части: первая часть используется для предварительных испытаний, вторая – для обнаружения катионов, третья – для обнаружения анионов, четвертая – для повторного исследования.
Date: 2015-08-15; view: 1791; Нарушение авторских прав