
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Применение орг. Реагентов в аналитической химии. Функц.-аналитическая группировка. Классификация орг. Реагентов по типу донорных атомов. Важн. Орг. Реагенты, исп. В хим. Анализе
|
|
Органические реагенты- это орг. Соединения различных классов, применяющиеся для обнаружения и количественного определения неорганических и органических в-в, а также для разделения, концентрирования, маскирования и др. вспомогательных или предварительных операций, предшествующих определению в-в любыми методами либо сопровождающих его. Одна из наиболее широких областей применения орг. Реагентов в аналитической химии- получение комплексных соединений с ионами металлов. Образующиеся продукты могут обл. ценными химико-аналитическими св-вами: интенсивность окрашивания, малая растворимость в воде, флуоресцентное излучение т.д.
Функционально-аналитическая группировка представляет собой совокупность функциональных групп, превращающая органическое соединение в реагент на определенное в-во или группу в-в. Напр., органические в-ва, сод. Группу –N=N-NH- образуют хелаты с Cd2+.
Хелатообразующие органические реагенты обычно классифицируют в зависимости от типа атомов, участвующих в комплексообразовании с ионом металла. Различают лиганды с одинаковыми(О,О; N,N; S,S) и разными(O,N; O,S; N,S) донорными атомами. Стр.332.
Реагенты для гравиметрического определения должны образовывать достаточно малорастворимые кристаллические осадки с определяемыми в-вами, но при этом сами хорошо растворяться в воде, а также обл. большой молярной массой(натриевая соль антраниловой к-ты). Известны орг. Реагенты, принимающие участие в окислительно-восстановительных р-циях. Такие реагенты исп. В качественном анализе(дифенилкарбазид при определении Cr2O7 2-), для маскирования мешающих ионов(аскорбиновая к-та) либо как окислительно-восстановительные индикаторы(дифениламин и др.).Подробнее стр.337-339
Произведение растворимости. Использование произведения растворимости для определения возможности выпадения осадка. Растворимость. Связь ионной и молекулярной растворимости в-ва с произведением растворимости.
При постоянной температуре произведение активностей ионов электролита(в степенях, равных соответствующим стехиометрическим коэффициентам) в его насыщенном р-ре является для данного растворителя величиной постоянной и называется термодинамическим произведением растворимости(константой растворимости) Кs = (aAz+)n · (aBx-)m. Термодинамической произведение растворимости подходит для описания идеальных систем либо систем, близких к идеальным. На практике исп. Концентрационное произведение растворимости, кот. Может быть реальным или условным. Реальное концентрационное произведение растворимости выражается через равновесные концентрации ионов, образующихся при растворении осадка:стр.382, ф. 11.4. Условным концентрационным произведением растворимости называется произведение(в степенях, равных стехиометрическим коэффициентам) общих концентраций всех форм существования катиона электролита и всех форм существования его аниона: ф. 11.5.
Если произведение концентраций(активностей) ионов в р-ре., взятых в степенях, равных стехиометрическим коэффициентам, окажется меньше величины произведения растворимости данного электролита, то в системе будет преобладать процесс растворения этого в-ва, а если больше- то процесс образования осадка. Если же это произведение окажется равным произведению растворимости, то система будет находится в состоянии равновесия.
Растворимостью называют общую концентрацию в-ва в его насыщенном р-ре. 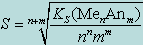 Это уравнение хар-ет ионную растворимость в-ва. Концентрация молекул в-ва в его насыщенном р-ре называется молекулярной растворимостью. Связь стр.386, ф. 11.12.
Это уравнение хар-ет ионную растворимость в-ва. Концентрация молекул в-ва в его насыщенном р-ре называется молекулярной растворимостью. Связь стр.386, ф. 11.12.
Date: 2015-08-15; view: 694; Нарушение авторских прав