
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные положения. Для описания движения атомов или частиц применяется классическая механика
|
|
Для описания движения атомов или частиц применяется классическая механика. Закон движения частиц находят при помощи аналитической механики.
Силы межатомного взаимодействия можно представить в форме классических потенциальных сил (как градиент потенциальной энергии системы).
Точное знание траекторий движения частиц системы на больших промежутках времени не является необходимым для получения результатов макроскопического (термодинамического) характера.
Наборы конфигураций, получаемые в ходе расчетов методом молекулярной динамики, распределены в соответствии с некоторой статистической функцией распределения, например отвечающей микроканоническому распределению.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Это уравнение связывает между собой макропараметр p состояния идеального газа и микропараметр (или), характеризующий движение молекулы. Для вывода основного уравнения MKT рассмотрим одноатомный идеальный газ, находящийся в термодинамическом равновесии, т.е. в состоянии, в котором все макроскопические параметры остаются неизменными во времени и по всему объему.
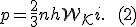
Оно связывает макропараметр p с микропараметром (или) и показывает, что понятие давления имеет смысл средней величины и неприменимо к отдельной молекуле.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид
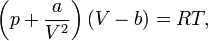
P— давление,
V— молярный объём,
t — абсолютная температура,
r — универсальная газовая постоянная.
Для молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
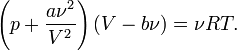
Недостатки уравнения Ван-дер-Ваальса
1. Для реальных веществ 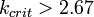
2. Для реальных веществ 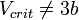 (скорее, 2b
(скорее, 2b
3. Уравнение Ван-дер-Ваальса расходится с экспериментом в области двухфазных состояний.
Date: 2015-08-07; view: 411; Нарушение авторских прав