
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Б) щелочная среда
|
|
+7 +3 +6 +5
2KMnO4 + NaNO2+ 2KOH → 2K2MnO4 + NaNO3 + H2O
Mn+7 + e → Mn+6 2
N+3 –2e → N+5 1
в) кислая среда
+7 +3 +2 +5
2KMnO4 + NaNO2+ 8H2SO4→ 2MnSO4 + NaNO3 + 6K2SO4 + H2O
Mn+7 + 5e → Mn+2 2
N+3 –2e → N+5 5
Концентрация окислителя или восстановителя
0 +6 +2 -2
a) 4Zn+5H2SO4(к) → 4ZnSO4 + H2S + 4H2O
Zn0 –2e → Zn+2 4
S+6 +8e → S-2 1
0 +1 +2 0
б) Zn+H2SO4(р) → ZnSO4 + H2
Zn0 –2e → Zn+2 1
2
2H+ +2e → H20 1
Природа окислителя и восстановителя
0 +5 +2 -3
a) 4Сa + 9HNO3(р) → 4Ca(NO3)2 + NH3 + 3H2O
Ca0 – 2e → Ca+2 4
8
N+5 + 8e → N-3 1
0 +5 +2 +2
б) 3Cu + 8HNO3(р) → 3Cu(NO3)2 + 2NO+ 4Н2О
Ca0 – 2e → Ca+2 1
2
N+5 + 2e → N+3
Температура
0 - +
a) CI2 + 2KOH → KCI +KCIO + H2O
Cl0 + e → Cl- 1
Cl0 – e → Cl+ 1
0 t0 - +5
б) 3CI2 + 6KOH → 5KCI +KCIO3 + 3H2O
Cl0 + e → Cl- 5
Cl0 – 5e → Cl+5 1
В стехиометрических расчетах окислительно-восстановительных процессов используют окислительные и восстановительные эквивалентные массы, которые определяются по формуле:
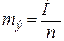 , (1)
, (1)
где mэ – эквивалентная масса окислителя (восстановителя);
М – мольная масса окислителя (восстановителя);
n – число электронов, принятых одной молекулой окислителя (отданных одной молекулой восстановителя).
В зависимости от условий реакции окислительно-восстановительные эквивалентные массы могут иметь различные значения.
Например, перманганат калия KMnO4 (М=158,0 г/моль) в кислой среде принимает пять электронов, его эквивалентная масса равна
mэ= 158,0/5=31,5 г/моль.
В сильнощелочной среде KMnO4 принимает один электрон,
mэ=158,0/1=158,0 г/моль.
В нейтральной и слабощелочной средах KMnO4 присоединяет три электрона,
mэ=158,0/3=52,7 г/моль.
Количественной характеристикой окислительно-восстановительной активности служит величина стандартного окислительно-восстановитель-ного потенциала. Стандартные окислительно-восстановительные потенциалы определяются по таблице. Чем выше алгебраическая величина потенциала, тем выше окислительная способность данного вещества в высшей степени окисления и наоборот, тем лучшим восстановителем является соединение в низшей степени окисления.
При стандартных условиях потенциал системы определяется по формуле Нернста:

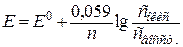 (2)
(2)
где Е0 – стандартный окислительно-восстановительный потенциал, В;
n – число электронов, принимающих участие в данной реакции;
сокис – концентрация окисленной формы;
свосст. – концентрация восстановленной формы.
Если KMnO4 окисляется в кислой среде согласно реакции
MnO4- + 8H+ + 5e → Mn+2 +4 H2O,
то окислительно-восстановительный потенциал системы определяется по уравнению:

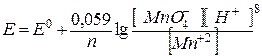 (3)
(3)
Условием протекания окислительно-восстановительной реакции является положительное значение разницы окислительно-восстановительных потенциалов:
Е0 = Е0окисл. – Е0восст. >0 (4)
Зная окислительно-восстановительные потенциалы, можно определить направление течения реакции. Например:
FeCl2 + SnCl4 →FeCl3 + SnCl2
Из таблицы находим окислительно-восстановительные потенциалы веществ, изменяющих степени окисления:
Е0 Fe+3/ Fe+2 =0,77 B; Е0 Sn+4/ Sn+2 =0,15 B.
Е0 >0 будет при условии, если в системе окислитель Fe+3/ Fe+2, а восстановитель Sn+4/ Sn+2 и реакция будет протекать в обратном направлении, т.е.:
2FeCl3 + SnCl2→ 2FeCl2 + SnCl4
Е0 = Е0окисл. – Е0восст.= 0,77 – (0,15) = +0,62 В
Date: 2015-07-27; view: 558; Нарушение авторских прав