
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Экспериментальная часть. Опыт №1. Влияние ph среды на окислительную активность иона и восстановительную активность ионаso32-
|
|
Опыт №1. Влияние pH среды на окислительную активность 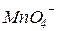 иона и восстановительную активность иона SO32-
иона и восстановительную активность иона SO32-
В три пробирки наберите по 1-2 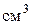 перманганата калия – В первую пробирку добавьте 1
перманганата калия – В первую пробирку добавьте 1 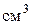 серной кислоты, во вторую - 1
серной кислоты, во вторую - 1 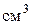 воды, в третью – 2
воды, в третью – 2 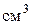 щёлочи. В каждую пробирку прилейте по 1
щёлочи. В каждую пробирку прилейте по 1 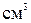 сульфита натрия. Наблюдайте изменения, происходящие в каждой пробирке:
сульфита натрия. Наблюдайте изменения, происходящие в каждой пробирке:
1. Какое вещество окрашивает раствор в жёлтый цвет в первой пробирке?
2. Какое вещество выпало в осадок во второй пробирке?
3. Какое вещество окрасило раствор в третьей пробирке?
4. Почему через некоторое время зелёный цвет в третьей пробирке исчезает и выпадает бурый осадок?
Составьте электронно-ионный баланс и запишите стехиометрические уравнения окислительно-восстановительных реакций в молекулярной и ионной форме.
Примечание: при выполнении работы используйте таблицу цветности ионов и молекул, приведённую на последней странице.
1)  .
.
2) 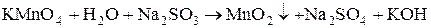 .
.
3) 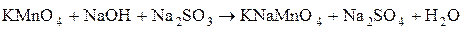 .
.
Опыт №.2. Окислительные свойства иона 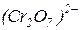 в кислой среде
в кислой среде
В пробирку наберите 1 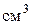 раствора бихромата калия
раствора бихромата калия 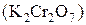 , добавьте 1
, добавьте 1 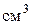 серной кислоты и внесите несколько кристаллов сульфита натрия
серной кислоты и внесите несколько кристаллов сульфита натрия 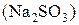 . Перемещайте раствор. Как изменилось окрашивание раствора? Составьте электронно-ионный баланс с учётом перехода иона
. Перемещайте раствор. Как изменилось окрашивание раствора? Составьте электронно-ионный баланс с учётом перехода иона 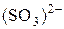 в ион
в ион 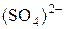 и запишите стехиометрическое уравнение окислительно-восстановительной реакции в ионной и молекулярной форме.
и запишите стехиометрическое уравнение окислительно-восстановительной реакции в ионной и молекулярной форме.
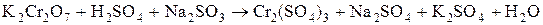
Опыт №.3. Восстановительные свойства иона 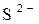 в щелочной среде
в щелочной среде
В пробирку наберите 1 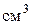 раствора сульфида натрия
раствора сульфида натрия 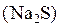 , добавьте 1
, добавьте 1 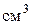 раствора щёлочи, а затем 1-2
раствора щёлочи, а затем 1-2 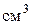 раствора нитрата висмута (III) -
раствора нитрата висмута (III) - 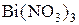 . Какое вещество выпало в осадок? Составьте электронно-ионный баланс с учётом перехода иона
. Какое вещество выпало в осадок? Составьте электронно-ионный баланс с учётом перехода иона 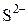 в ион
в ион 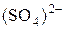 и запишите стехиометрическое уравнение окислительно-восстановительной реакции в ионной и молекулярной форме.
и запишите стехиометрическое уравнение окислительно-восстановительной реакции в ионной и молекулярной форме.
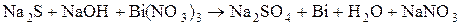 .
.
Опыт №4. Восстановительные свойства пероксида водорода Н2О2 в кислой и нейтральной среде
В две пробирки наберите по 1 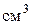 раствора перманганата калия
раствора перманганата калия 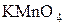 . В первую пробирку добавьте 1-2
. В первую пробирку добавьте 1-2 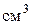 2H – серной кислоты, а во вторую – немного воды. В обе пробирки прилейте по 1-2
2H – серной кислоты, а во вторую – немного воды. В обе пробирки прилейте по 1-2 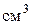 3% - процентного раствора пероксида водорода. Что наблюдается? Почему обесцветился раствор в первой пробирке? Какое вещество выпало в осадок во второй пробирке? Составьте электронно-ионный баланс с учётом выделения газа-кислорода из
3% - процентного раствора пероксида водорода. Что наблюдается? Почему обесцветился раствор в первой пробирке? Какое вещество выпало в осадок во второй пробирке? Составьте электронно-ионный баланс с учётом выделения газа-кислорода из 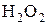 и запишите стехиометрические уравнения окислительно-восстановительной реакции в ионной и молекулярной форме.
и запишите стехиометрические уравнения окислительно-восстановительной реакции в ионной и молекулярной форме.
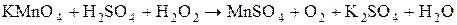 .
.
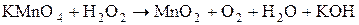 .
.
Опыт №5. Окислительные свойства пероксида водорода Н2О2 в кислой среде.
Наберите в пробирку 1мл раствора иодида калия (KI), добавьте 1-2 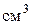 раствора соляной кислоты, а затем 1
раствора соляной кислоты, а затем 1 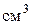 пероксида водорода. Как изменилось окрашивание раствора?
пероксида водорода. Как изменилось окрашивание раствора?
Составьте электронно-ионный баланс с учётом перехода 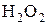 в молекулы воды. Запишите стехиометрическое уравнение окислительно-восстановительной реакции в ионной и молекулярной форме.
в молекулы воды. Запишите стехиометрическое уравнение окислительно-восстановительной реакции в ионной и молекулярной форме.
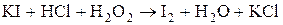
Опыт №6. Восстановительные свойства дигидроксида никеля (II) 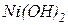 в присутствии различных окислителей.
в присутствии различных окислителей.
В две пробирки налейте по 1-2 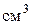 раствора сульфата или нитрата никеля (II). В каждую пробирку добавьте по 1-2
раствора сульфата или нитрата никеля (II). В каждую пробирку добавьте по 1-2 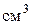 раствора щёлочи до выпадения осадка
раствора щёлочи до выпадения осадка 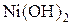 . В первую пробирку прилейте 1
. В первую пробирку прилейте 1 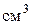 раствора перманганата калия
раствора перманганата калия 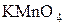 , а во вторую - 1
, а во вторую - 1 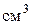 раствора хромата калия
раствора хромата калия 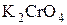 .
.
Что наблюдается? Используя таблицу цветности ионов и молекул, определите, в какие вещества превратился дигидроксид никеля. Составьте электронно-ионный баланс с учётом перехода иона 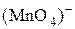 в ион
в ион 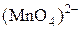 , а иона
, а иона  в ион
в ион 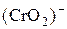 . Запишите стехиометрические уравнения окислительно-восстановительных реакций в ионной и молекулярной форме. Сделайте вывод о сравнительной окислительной активности ионов
. Запишите стехиометрические уравнения окислительно-восстановительных реакций в ионной и молекулярной форме. Сделайте вывод о сравнительной окислительной активности ионов 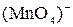 и
и 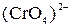 в щелочной среде.
в щелочной среде.
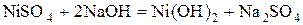 ,
,
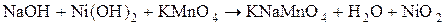 ,
,
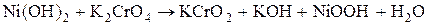 .
.
ЛИТЕРАТУРА
1. Химия: Справ. Изд./ В.Шретер, К.-Х.Лаутеншлегер, Х.Бибрак и др.: Пер. с нем. – М.:Химия, 1989, 648 с.
2. Глинка Н.Л. Общая химия:Учебное пособие для вузов./ Под ред. В.А.Рабиновича. Л.: Химия, 1984, 704 с.
ОГЛАВЛЕНИЕ
Введение…………………………………………………………………….…….3
1.Окислительно-восстановительные реакции.
Основные понятия и определения……………………………………………….3
2.Важнейшие окислители и восстановители……………………………………….5
2.1.Восстановители……………………………………………………………….5
2.2.Окислители……………………………………………………………………6
2.3.Окислительно-восстановительная двойственность………………………..8
3.Составление уравнений окислительно-восстановительных реакций
методом электронного баланса………………………………………………….9
4. Экспериментальная часть………………………………………………………...9
Литература………………………………………………………………………….13
Date: 2015-07-27; view: 706; Нарушение авторских прав