
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные понятия и определения. Методические указания к лабораторным работам по курсу
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Методические указания к лабораторным работам по курсу
«Химия»
Составители: C.Б.Белова
С.П.Белов
Н.Д.Гришина
Т.К.Горлачева
МОСКВА 2006
ВВЕДЕНИЕ
Важнейшими критериями, по которым проводят классификацию химических реакций являются
агрегатное состояние реагентов (реакции газовые, в растворе, твердофазные, между веществами в различных агрегатных состояниях);
вид реагирующих частиц (реакции молекулярные, ионные, радикальные);
вид переносимых частиц (реакции окислительно-восстановительные с переносом электронов, кислотно-основные с переносом протонов, образования и разрушения комплексов с переносом ионов и молекул, образования и разрушения ионных кристаллов);
вид источника энергии (реакции термохимические, фотохимические и электрохимические).
К основным типам химических реакций в неорганической химии относятся реакции ионные, окислително-восстановительные, кислотно-основные и электрохимические.
Основной характеристикой окислительно-восстановительных реакций является изменение степени окисления элементов в результате переноса элементарных химических частиц – электронов от одного элемента к другому.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Окислительно-восстановительные реакции – это реакции, в результате которых изменяюется степень окисленности элементов.
Окисленность – неравномерность распределения электронов между атомами в соединениях.
- Элемент, электроны которого смещаются к атомам другого элемента (полностью в случае ионной связи и частично в случае ковалентной полярной), проявляет положительную окисленность.
- Элемент, к атомам которого смещаются электроны атома другого элемента, проявляет отрицательную окисленность.
Степень окисленности (с.о.) – число электронов, смещённых от одного атома данного элемента (при положительной окисленности) или к одному атому данного элемента (при отрицательной окисленности).
В простых веществах степень окисленности всегда равна 0.
В химических соединениях некоторые элементы проявляют всегда одну и ту же степень окисленности, но для большинства элементов она в различных соединениях различна.
 Постоянную степень окисленности имеют:
Постоянную степень окисленности имеют:
 Щелочные металлы +1 Н в большинстве О -2
Щелочные металлы +1 Н в большинстве О -2
Металлы главной подгруппы соединений +1 - перекисные соединения
2 группы, Zn и Cd +2 В гидридах металлов 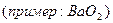 -1
-1
F -1 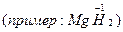 -1
-1
Al +3 - 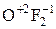 +2
+2
Для элементов с непостоянной степенью окисленности её значение можно подсчитать, зная формулу соединения и учитывая, что сумма с.о. всех атомов в молекуле равна 0.
В окислительно-восстановительных реакциях степень окисленности элементов изменяется.
Пример: 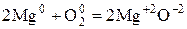
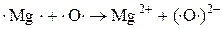

При окислении Mg молекулярным 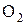 каждый атом Mg передаёт 2 валентных электрона атому О.
каждый атом Mg передаёт 2 валентных электрона атому О.
Таким образом, в соответствии с теорией электронного строения атома окислительно-восстановительные реакции интерпретируются как процессы отдачи и приёма электронов. Электроны не уходят из сферы реакции, а переносятся от одного элемента (восстановителя) к другому (окислителю).
Окислительно-восстановительную реакцию можно представить в виде двух полуреакций.
Полуреакция окисления (отдача электронов): 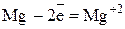
Полуреакция восстановления (приём электронов): 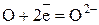
Число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равен числу электронов, присоединяемых молекулами (атомами, ионами) окислителя. В рассмотренном примере 1 молекула кислорода - 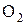 окисляет 2 атома магния -
окисляет 2 атома магния - 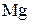 .
.
Окисление – это процесс отдачи электронов.
Восстановление – это процесс приёма электронов.
Окислитель – вещество, которое принимает электроны и при этом восстанавливается. Степень окисления при этом понижается. (с.о. 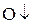 )
)
Восстановитель – вещество, которое отдаёт электроны и при этом окисляется. Степень окисления при этом возрастает. (с.о. 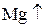 )
)
Date: 2015-07-27; view: 555; Нарушение авторских прав