
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Адиабатный процесс протекает при постоянной энтропии
|
|
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Кроме того, можно представить множество процессов, не противоречащих первому началу, в которых энергия сохраняется, а в природе они не осуществляются. Появление второго начала термодинамики связано с необходимостью получить ответ на вопрос, какие процессы в природе возможны, а какие нет.
Мы говорили о том, что энтропия изолированной термодинамической системы может только возрастать, либо, по достижении максимального значения оставаться постоянной. Это утверждение носит название второго начала термодинамики.
Иногда второе начало термодинамики формулируют следующим образом: невозможен перпетуум мобиле (вечный двигатель) второго рода, т.е. такой периодический двигатель, который получал бы теплоту от одного резервуара и превращал её полностью в работу.
У. Томпсону принадлежит такая формулировка второго начала термодинамики:
Невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от какого-то тела некоторого количества теплоты и превращение этого количества теплоты полностью в работу.
На первый взгляд может показаться, что формулировке Томсона противоречит процесс изотермического расширения идеального газа. Действительно, в ходе этого процесса всё полученное от нагревателя количество теплоты превращается полностью в работу. Однако получение теплоты и превращение её в работу не является единственным конечным результатом, кроме того, происходит изменение объёма газа.
Т.е. для изолированной системы:
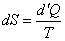 , ,
| (34) |
следовательно, d ¢Q = 0, а dS = 0, т.е. S = const.
В ходе обратимого процесса, протекающего в изолированной системе, энтропия остается постоянной.
Протекание в изолированной системе необратимого процесса приводит к росту энтропии: dS > 0, тогда в ходе необратимого процесса:
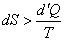 . .
| (35) |
Под температурой Т здесь понимается температура теплового резервуара, от которого данная система получает количество теплоты d¢Q.
Объединим формулы (35) и (34) в одно неравенство, оно носит название неравенство Клаузиуса:
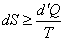 . .
| (36) |
Клаузиус сформулировал второе начало термодинамики таким образом:
Date: 2015-07-27; view: 650; Нарушение авторских прав