
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Внутренняя энергия есть величина аддитивная. Внутренняя энергия является однозначной функцией состояния системы
|
|
Приращение внутренней энергии при переходе системы из одного состояния в другое, всегда равно разности значений внутренней энергии в конечном и начальном состояниях независимо от пути, по которому совершается переход:
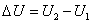 . .
| (5) |
Так как средняя энергия одной молекулы определяется соотношением:
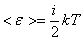 . .
| (6) |
где i – число степенней свободы,
k – постоянная Больцмана,
Т – термодинамическая температура.
Числом степеней свободы механической системы называется количество независимых величин, с помощью которых может быть задано положение ситемы в пространстве. Твердое тело имеет шесть степеней свободы – i = 6,
Одноатомный газ – i = 3, двухатомный газ с жёсткой связью между молекулами – i = 5.
Средняя энергия одного моля газа (в идеальном газе молекулы между собой не взаимодействуют) равна внутренней энергии одного моля газа:
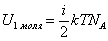 . .
| (7) |
Для произвольной массы газа величина внутренней энергии равна:
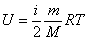 . .
| (8) |
Внутренняя энергия является функцией температуры – U = f (T).
Изменение внутренней энергии возможно двумя способами: путем совершения работы над телом – А и передачей ему количества теплоты – Q.
Работу, совершаемую данным телом над внешними телами будем обозначать – А, а работу, совершаемую внешними телами над данным телом – через А ¢. Тогда:
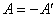 . .
| (9) |
Пусть: Q – количество теплоты, переданное данному телу внешней средой.
Q ¢ – количество теплоты, переданное данным телом внешней среде.
Для одного и того же процесса:
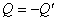 . .
| (10) |
Работа А и количество теплоты Q измеряются в Дж. Если состоянию 1 соответствует внутренняя энергия U 1, а состоянию 2 соответствует внутренняя энергия U 2 , то приращение внутренней энергии системы может происходить за счет передачи системе некоторого количества теплоты Q и совершения над системой работы – А ¢, т. е.
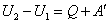 . .
| (11) |
Физическая природа теплопередачи заключается в том, что определенные молекулы более нагретого тела совершают работу (A > 0) над молекулами менее нагретого тела, а также происходит обмен энергией между отдельными молекулами через излучение.
Теплота Q определяет количество энергии, переходящая от одного тела к другому посредством теплопередачи.
Закон сохранения энергии термодинамики называется первым началом термодинамики и имеет вид:
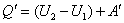 . .
| (12) |
Формула (12) есть математическая запись первого начала термодинамики, а его словесные формулировки звучат так:
1-ая формулировка – Количество теплоты, сообщенное системе, идет на приращение внутренней энергии и на совершение системой работы против внешних тел.
2-ая формулировка– Невозможен перпетуум мобиле первого рода, т.е. такой периодически действующий двигатель, который бы совершал работу в большем количестве, чем получаемая им извне энергия.
При вычислении работы и теплоты рассматриваемый процесс приходится разбивать на ряд элементарных процессов, соответствующих очень малому изменению параметров системы, тогда (12) принимает вид:
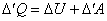 , ,
| (13) |
где 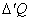 – элементарное количество теплоты,
– элементарное количество теплоты,
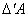 – элементарная работа,
– элементарная работа,
D U – приращение внутренней энергии в ходе данного элементарного процесса.
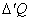 и
и 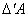 – не являются приращениями величин Q и А.
– не являются приращениями величин Q и А.
При переходе к дифференциалам уравнение (13) принимает вид:
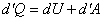 . .
| (14) |
Приращение внутренней энергии в термодинамическом процессе, при котором система переходит из состояния 1 в состояние 2. равно:
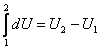 . .
| (15) |
Из соотношения (15) следует, что этот интеграл не зависит от формы пути, по которому осуществляется интегрирование.
Работа, совершенная в термодинамическом процессе, при котором система переходит из состояния 1 в состояние 2 равна:
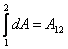
| (16) |
Количество теплоты, полученное системой в процессе, можно рассчитать по соотношению (17):
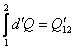 . .
| (17) |
Отметим, что величины А 12 и Q ′12, определяемые формулами (16) и (17), не являются функциями состояния, а зависят от пути, по которому происходит интегрирование.
Величину работы, совершённой газом при изменении объёма, можно рассчитать по формуле:
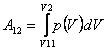 . .
| (18) |
Если процесс обратимый, и известен его вид на диаграмме p, V, то работа, совершаемая при обратимом круговом процессе, численно равна площади, охватываемой кривой, изображающей цикл. Если обход по циклу совершается по часовой стрелке, то работа за цикл будет А 12 > 0, а если против – то А 12 <0.
Из экспериментальных опытов известно, что сообщение разным телам одинакового количества теплоты приводит к нагреванию их до различной разности температур. Тогда необходимо ввести новую характеристику, называемую теплоёмкостью.
Теплоёмкостью какого-либо тела называется величина, равная количеству теплоты, которое необходимо сообщить телу, чтобы повысить его температуру на 1 кельвин:
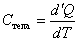 , ,
| (19) |
где d'Q – количество теплоты, сообщение которого повышает температуру на dT кельвин. Теплоёмкость тела измеряется в СИ в джоулях на кельвин (Дж/·К ).
Теплоёмкость единицы массы вещества называется удельной, будем обозначать её строчной буквой – с, измеряется она в СИ в джоулях на кельвин (Дж/кг·К ) и определяется так:
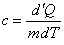 . .
| (20) |
В физике предпочитают использовать теплоемкость моля вещества – молярную теплоёмкость веществ, будем обозначать её прописной буквой – Сμ,измеряется она в СИ в (Дж/моль·К ) и определяется так:
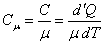 . .
| (21) |
Удельная и молярная теплоёмкости взаимосвязаны между собой соотношением:
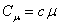 . .
| (22) |
Теплоёмкость зависит от условий нагревания тела.
Рассмотрим два процесса, возможных в термодинамических системах.
1) Пусть изолированная система, состоит из двух тел, температура которых в начальный момент неодинакова. Процесс теплопередачи будет происходить до тех пор, пока температура обоих тел не выровняются. После этого система будет оставаться неограниченно долго в этом состоянии.
Date: 2015-07-27; view: 852; Нарушение авторских прав