
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Параметри процесу стиску. Середній показник адіабати стиску при ε = 16,5 і Ta =358K визначаємо за графіком, який наведено на рисунку 3.3
|
|
Середній показник адіабати стиску при ε = 16,5 і Ta =358K визначаємо за графіком, який наведено на рисунку 3.3. k1=1,363.
Підвищення середньої температури двигуна за рахунок наддуву зменшує значення показника політропи стиску n 1, а достатня швидкохідність дизеля може дещо підняти значення n 1. k1= n 1
Приймаємо n 1=1,363.
Тиск в кінці процесу стиску визначаємо за формулою:
р с = ра· 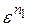 = 0,15·16,51,363=6.847 МПа.
= 0,15·16,51,363=6.847 МПа.
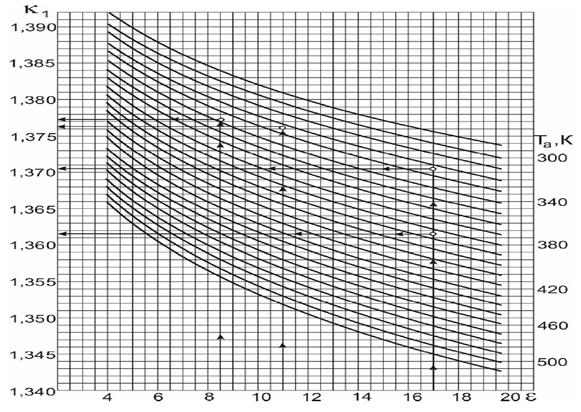
Рисунок 1.1 – Номограма для визначення показника адіабати стиску к1
Величина показника політропи стиску n 1 визначається на основі дослідних даних залежно від ступеня стиску і температури в кінці процесу стиску Та. Для автотракторних двигунів n 1 =(к 1 – 0,01 )…(к 1 – 0,04 ), де к 1 – показник адіабати стиску, який залежить від ε і Та. Визначається з номограми (рисунок 1.1).
Приймаємо n 1=1,36.
Температуру в кінці процесу стиску визначаємо за формулою:
Т с =Та· 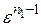 = 376·16,50,363 = 1040 К.
= 376·16,50,363 = 1040 К.
За формулами, які наведено в таблиці 1.1, середня мольна теплоємність в кінці процесу стиску при сталому об’ємі для повітря і компонентів залишкових газів становить:
Таблиця 1.1 – Середні мольні теплоємності для газів
| Найменування газу | Формула для визначення mcv залежно від температури | ||
| - | від 0 до1500°С | від 1501 до2800°С | |
| Повітря | - | 20,6+0,002638· t | 22,387+0,00145· t |
| Кисень | O2 | 20,930+0,004641 ·t-0,00000084· t2 | 23,723+0,00155· t |
| Нітроген (азот) | N2 | 20,398+0,0025· t | 21,951+0,001457 ·t |
| Гідроген (водень) | H2 | 20,684+0,000206· t+0,000000588 ·t2 | 19,678+0,001758·t |
| Окись вуглецю | CO | 20,597+0,00267· t | 22,49+0,001430 ·t |
| Вуглекислий газ | CO2 | 27,941+0,019· t- 0,0000055· t2 | 39,123+0,003349 ·t |
| Водяна пара | H2O | 24,953+0,005359 ·t | 26,67+0,004438 ·t |
Визначаємо середню молярну теплоємність заряду (повітря) без врахування залишкових газів [1]:
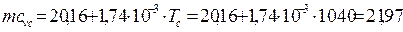 кДж/(кмоль·К).
кДж/(кмоль·К).
Середня мольна теплоємність в кінці процесу стиску:
(визначається за формулами, які наведено в таблиці 3.1).
А) - повітря 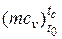 =20,6+0,002638·10-3· tc;
=20,6+0,002638·10-3· tc;
де tc= Тс – 273= 767°C
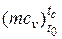 =20,6+0,002638·10-3· tc = 20,6+0,002638·10-3· 767= 20,602кДж/(кмоль·К),
=20,6+0,002638·10-3· tc = 20,6+0,002638·10-3· 767= 20,602кДж/(кмоль·К),
–вуглекислий газ СО2 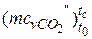 = 27,941+0,019· tс – 0,000005487· t2с = =27,941+0,019·767 – 0,000005487·7672 = 39,286 кДж/(кмоль·К);
= 27,941+0,019· tс – 0,000005487· t2с = =27,941+0,019·767 – 0,000005487·7672 = 39,286 кДж/(кмоль·К);
– водяна пара 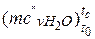 = 24,953+0,05359· tс = 24,953+0,05359·767=
= 24,953+0,05359· tс = 24,953+0,05359·767=
= 66,057 кДж/(кмоль·К);
– кисень 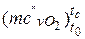 = 20,930 +0,004641· tс – 0,00000084· t2с =20,930+ +0,004641·767– 0,00000084·7672 =23,995 кДж/(кмоль·К);
= 20,930 +0,004641· tс – 0,00000084· t2с =20,930+ +0,004641·767– 0,00000084·7672 =23,995 кДж/(кмоль·К);
– азот 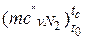 = 20,398+0,0025· tс = 20,398+0,0025·767=
= 20,398+0,0025· tс = 20,398+0,0025·767=
= 22.316 кДж/(кмоль·К).
Б)залишкових газів при a =1,6 і t с =7670С визначаємо за формулою:
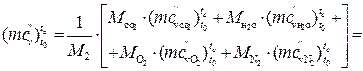
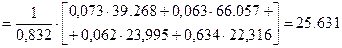
кДж/(кмоль·К).
в) робочої суміші mcv’ (свіжий заряд + залишкові гази) визначаємо за формулою:
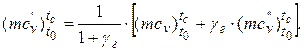
Після підстановки значень параметрів знаходимо:
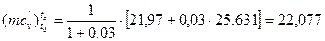 кДж/(кмоль·К).
кДж/(кмоль·К).
За формулою, яку наведено в [1], середнє значення теплоємності у процесі стиску без врахування залишкових газів:
mcvс = 20,16 + 1,74·10-3· Тс =20,16 + 1,74·10-3·1040= 21.97 кДж/(кмоль·К).
Таким чином, отримане середнє значення теплоємності робочої суміші знаходиться у існуючих межах  = 20…25 кДж/(кмоль·К).
= 20…25 кДж/(кмоль·К).
Визначаємо кількість молів залишкових газів (кмоль):
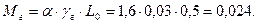
Визначаємо кількість молів газів в кінці процесу стиску до згоряння(кмоль):
Мс = М1+Мг =0,8+0,024= 0,824.
Date: 2015-07-27; view: 591; Нарушение авторских прав