
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Температура горения газов
Различают следующие температуры горения газов: калориметрическая, теоретическая и действительная.
Калориметрическая температура – это температура продуктов сгорания горючих газов в адиабатических условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха. Калориметрическая температура может быть рассчитана по формуле:
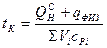 , (10.12)
, (10.12)
где 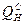 – низшая теплота сгорания газа;
– низшая теплота сгорания газа;
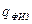 – теплосодержание воздуха и газа;
– теплосодержание воздуха и газа;
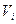 – объем i-го компонента продуктов сгорания газов;
– объем i-го компонента продуктов сгорания газов;
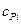 – теплоемкость i-го компонента продуктов сгорания газов.
– теплоемкость i-го компонента продуктов сгорания газов.
Теплосодержание (энтальпия) воздуха и газа вычисляются по формуле:
 ,
,
где 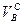 – объем воздуха сухого, необходимый для полного сжигания газа;
– объем воздуха сухого, необходимый для полного сжигания газа;
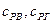 – теплоемкость воздуха и газа;
– теплоемкость воздуха и газа;
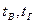 – температура воздуха и газа.
– температура воздуха и газа.
Знаменатель формулы 10.12 в развернутом виде
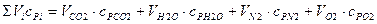 .
.
Теплоемкость продуктов сгорания величина не постоянная и увеличивается с повышением температуры, поэтому калориметрическая температура рассчитывается методом итераций (последовательных приближений). Примерные значения калориметрической температуры некоторых газов при сжигании в сухом воздухе при нормальных условиях и коэффициенте α = 1 приведены в таблице 10.2.
Таблица 10.2. Калориметрическая температура горения газов
| Наименование газа | Температура, °С |
| Водород | |
| Метан | |
| Пропан | |
| Ацетилен | |
| Природный газ | |
| Доменный газ | |
| Сжиженный газ |
С увеличением влажности воздуха температура снижается на 25 – 20 градусов на каждый весовой процент влаги. К снижению температуры приводит уменьшение и увеличение коэффициент α относительно α = 1.
Теоретическая температура – это температура продуктов сгорания горючих газов в адиабатических условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха с учетом химической неполноты сгорания и реакций диссоциации. Реакции диссоциации – распад молекул продуктов сгорания под воздействием высокой температуры. Например:
Н2О ↔ Н2 + 0,5О2 – 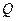 ;
;
СО2 ↔ СО + 0,5О2 – 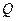 .
.
При протекании реакций диссоциации теплота поглощается и в результате температура горения снижается. Теоретическая температура рассчитывается по формуле:
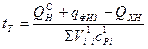 , (10.13)
, (10.13)
где 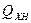 – химическая неполнота сгорания, включая потери теплоты на
– химическая неполнота сгорания, включая потери теплоты на
диссоциацию продуктов сгорания;
 – сумма произведений объемов и средних теплоемкостей с учетом диссоциации на 1 м3 газа.
– сумма произведений объемов и средних теплоемкостей с учетом диссоциации на 1 м3 газа.
Степень диссоциации определяется по константам диссоциации для каждой реакции. До температуры 1500°С диссоциацию можно не учитывать.
Действительная температура – это температура продуктов сгорания горючих газов в действительных условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха с учетом химической неполноты сгорания и реакций диссоциации. Действительные условия отличаются от адиабатических условий, т.к. всегда есть потери теплоты в окружающую среду.
Действительная температура находится по формуле:
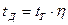 , (10.14)
, (10.14)
где  – пирометрический коэффициент.
– пирометрический коэффициент.
Величина пирометрического коэффициента зависит от печей и их тепловой изоляции. Принимается в пределах от 0,5 до 0,85.
Date: 2015-07-27; view: 725; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |