
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реакции горения и их тепловой эффект
Министерство образования и науки Российской Федерации
Тольяттинский государственный университет
Кафедра «Теплогазоснабжение и вентиляция»
В.Н. Пелипенко
ГАЗОСНАБЖЕНИЕ
Конспект лекций
Часть 2

Тольятти
ТГУ
ОСНОВЫ ТЕОРИИ ГОРЕНИЯ ГАЗОВ
Проектирование и расчет газогорелочных устройств являются сложной инженерной задачей. На этом этапе решаются вопросы, как эффективного сжигания газа, так и вопросы безопасности процесса горения для человека и окружающей природной среды. Поэтому специалисты в области газоснабжения должны знать теоретические основы процесса горения газов.
Реакции горения и их тепловой эффект
По современным теоретическим представлениям г орение – быстро протекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты, резким повышением температуры и излучением. Обычно горение происходит в воздухе, и горючие компоненты топлива окисляются кислородом воздуха. Видимое горение называют пламенем. Соответственно пламя – газообразная среда, в которой происходит горение.
Реакции горения описываются химическими уравнениями, которые характеризуют качественно и количественно вступающие в реакцию и образующиеся в её результате вещества. Например:
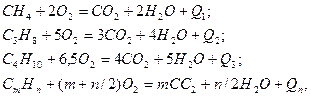
где 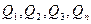 – тепловой эффект реакции.
– тепловой эффект реакции.
Кроме углеводородных газов в составе горючих газов могут быть водород, оксид углерода и сероводород. Соответственно химические уравнения их реакций горения:
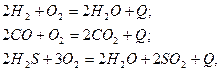
где  – тепловой эффект реакции.
– тепловой эффект реакции.
В составе горючих газов могут быть инертные газы: азот, диоксид углерода и вода в виде пара. Эти газы не окисляются кислородом и являются балластными компонентами. Все выше написанные химические уравнения называются стехиометрическими, т.к. кислорода достаточно для полного окисления всех горючих компонентов.
Тепловой эффект реакции горения называют еще теплотой сгорания или теплотворной способностью. Различают низшую и высшую теплоту сгорания. Низшей теплотой сгорания (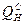 ) – называется то количество теплоты, которое выделяется при полном сгорании газа, когда содержащаяся в продуктах сгорания вода остается в парообразном состоянии (паровой фазе).
) – называется то количество теплоты, которое выделяется при полном сгорании газа, когда содержащаяся в продуктах сгорания вода остается в парообразном состоянии (паровой фазе).
Высшей теплотой сгорания (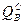 ) – называется то количество теплоты, которое выделяется при полном сгорании газа, когда содержащаяся в продуктах сгорания вода выделяется в сконденсированном виде, т.е. в виде жидкости. На практике чаще используется величина низшей теплоты сгорания, т.к. при сжигании газа в бытовых приборах, котлах, промышленных печах и сушилах вода, как правило, остается в парообразном виде. Величины теплоты сгорания индивидуальных горючих газов известны и приведены в справочниках и учебниках. В таблице 10.1 приведены теплоты сгорания основных компонентов горючих газов при нормальных условиях.
) – называется то количество теплоты, которое выделяется при полном сгорании газа, когда содержащаяся в продуктах сгорания вода выделяется в сконденсированном виде, т.е. в виде жидкости. На практике чаще используется величина низшей теплоты сгорания, т.к. при сжигании газа в бытовых приборах, котлах, промышленных печах и сушилах вода, как правило, остается в парообразном виде. Величины теплоты сгорания индивидуальных горючих газов известны и приведены в справочниках и учебниках. В таблице 10.1 приведены теплоты сгорания основных компонентов горючих газов при нормальных условиях.
Таблица 10.1. Теплоты сгорания некоторых горючих газов
| Наименование газа | 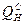 , МДж/нм3 , МДж/нм3
| 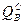 , МДж/нм3 , МДж/нм3
|
| Метан | 35,84 | 39,86 |
| Этан | 63,73 | 70,42 |
| Пропан | 93,37 | 101,74 |
| Водород | 10,80 | 12,77 |
| Оксид углерода | 12,64 | 12,64 |
Низшая теплота сгорания газа (смеси) вычисляется по формуле:
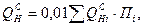
где Пi – процентное содержание i -го компонента в смеси.
Date: 2015-07-27; view: 2392; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |