
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Прочность и сопротивление коррозионному растрескиванию коррозионностойких сталей
|
|
| Марка стали | Класс | σв | σ0,2 | σкр |
| МПа | ||||
| 08Х17Т | Ферритный | |||
| 15Х25Т | То же | |||
| 08Х18Н10Т | Аустенитный | |||
| 10Х14Г14Н4Т | То же | |||
| 10Х17Н13М2Т | То же | |||
| 08Х22Н6Т | Аустенитно-ферритный | |||
| 08Х21Н6М2Т | То же | |||
| 08Х18Г8Н2Т | То же |
Испытания на коррозионное растрескивание могут проводиться либо в условиях, вызывающих разрушение материалов (испытания на растяжение, на вязкость разрушения и усталость), либо путем определения времени появления первой трещины. Последний вид испытаний состоит в фиксации нагруженных образцов в специальных приспособлениях или с помощью создания напряжений клином в разрезанных кольцах (рис. 10.11). Время до появления трещин характеризует стойкость материалов против коррозионного растрескивания.
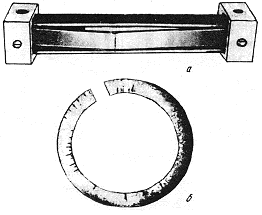
Рис.10.11. Испытание на коррозионное растрескивание в струбцине (а) и на кольцах (б) с клином для
определения времени до образования
коррозионных трещин
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ (Ю.П. Солнцев)
Многообразие процессов электрохимической коррозии и условий ее проявления обусловили широкий диапазон способов защиты от этого явления. Многое зависит от конструкции изделия. Конструктор-проектировщик первым должен предусмотреть защиту от коррозии. Он должен рационально подобрать материалы и так спроектировать конструкцию, чтобы максимально ограничить влияние неизбежных анодных областей и появление таких областей в ходе эксплуатации.
Методы защиты от коррозии можно объединить в следующие группы:
1. Нанесение защитных покрытий и пленок.
2. Изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз.
3. Модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. Его эффективность зависит не только от выбора подходящего покрытия, но и от соответствующей обработки поверхности материала. Она должна быть очищена от органических загрязнений, таких как масла и смазки, а также от ржавчины, окалины и т. п. В связи с этим подготовка поверхности состоит в мытье, обезжиривании, механической очистке шлифованием, полированием, очистке щетками или дробеструйной обработке. Чистую поверхность металла получают также химическим или электролитическим травлением в растворах кислот.
В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больше, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей среды. Поэтому свою роль они выполняют только при наличии полной сплошности. Если в катодном покрытии образуется щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла — анодным элементом. Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможных несплошностях катодных покрытий, их делают сравнительно большой толщины.
Схематически этот вид разрушения показан на рис. 10.2, а.
Анодные покрытия — это покрытия, выполненные из металла с меньшим электродным потенциалом, чем у защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями являются цинк, кадмий, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла от коррозионной среды, но и в электрохимическом воздействии. В случае нарушения покрытия и образовании коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие несплошности в анодных покрытиях не опасны (рис. 10.2, б).
Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение получает нанесение покрытий в вакууме. В этом случае покрытия получают испарением металлов в вакууме с последующей конденсацией паров на защищаемой поверхности. Этим способом производят алюминирование, кадмирование и цинкование в вакууме стальных деталей.
Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих средах. К ним, в частности относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средствами, как, например, красками, лаками и т. п. Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия достаточно стойкие к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и низкая стойкость в условиях резких перепадов температуры.
Органические покрытия выполняются с помощью разнообразных лакокрасочных материалов.
Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и уменьшение агрессивности среды, окружающей металлоконструкцию.
Катодная зашита состоит в присоединении к защищаемой конструкции анода протектора с более отрицательным электрохимическим потенциалом. Протектор (от слова «protection» – защита) и служит таким анодом, препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается.
Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал. Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе не происходило быстрого разрушения протектора.
Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или болтами. Катодную или протекторную защиту широко используют при защите от морской и подземной коррозии металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого металла к отрицательному полюсу постоянного тока. На рис. 10.12 приведены примеры катодной защиты.
Для уменьшения агрессивности окружающей среды в нее вводят добавки, называемые ингибиторами коррозии, которые или способствуют пассивации металла, или значительно снижают скорость коррозии металлов. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава.
Различают анодные и катодные ингибиторы. В качестве анодных ингибиторов коррозии используют различные вещества, образующие нерастворимые соединения на анодных участках. Одним из таких пассиваторов является хромпик K2Сr2О7, вводимый в количестве 2–3 г/л раствора охлаждающей жидкости.
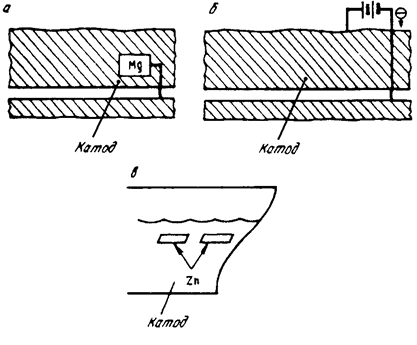
Рис. 10.12. Примеры катодной защиты стали:
а) катод — сталь, анод — Zn или Mn;
б) защита присоединением к источнику постоянного тока;
в) протекторная защита корпуса корабля
Катодные ингибиторы тормозят катодный процесс. К их числу относятся различные травильные присадки, добавляемые в количестве 1–2 % в кислоты для снятия окалины без разрушения основного металла.
Летучие ингибиторы такие, как нитрат натрия NaNO2, применяют для пропитки бумаги, в которую заворачивают детали, подлежащие хранению или транспортировке. Испаряясь, они насыщают окружающее детали пространство и создают защитную газовую среду. Летучие ингибиторы характеризуются высокой эффективностью. Стальные изделия, завернутые в бумагу, обработанную NaNO2 в условиях относительной влажности 85 %, не ржавеют в течение 5 лет. Преимуществом летучих ингибиторов является отказ от применения защитных покрытий, удобство расконсервации и постоянная готовность деталей к немедленному использованию без дополнительной обработки.
ХРОМИСТЫЕ СТАЛИ МАРТЕНСИТНОГО, МАРТЕНСИТНО-ФЕРРИТНОГО И ФЕРРИТНОГО КЛАССОВ (Н.С. Самойлов)
Стойкость сталей и сплавов этого класса против электрохимической, химической коррозии (атмосферной, почвенной, щелочной, кислотной, солевой), межкристаллитной коррозии, коррозии под напряжением и др. определяется в первую очередь их составом.
Однако большое влияние на служебные свойства сталей и сплавов оказывают также термическая обработка, сварка, горячая пластическая деформация, качество поверхности металла и другие факторы.
В зависимости от основной структуры, полученной при охлаждении на воздухе после высокотемпературного нагрева, эти стали и сплавы подразделяют на следующие классы:
1) мартенситный — стали с основной структурой мартенсита (хромистые стали с 12–17 % Cr, содержащие более 0,15 % С и, специальные добавки Мо, W, V и небольшое количество Ni — до 3 %);
2) мартенситно-ферритный — стали, содержащие в структуре кроме мартенсита не менее 10 % феррита (хромистые стали с 13–18 % Cr и низким содержанием С – до 0,15 %, в ряде случаев с добавками Al, Ti, Ni, Si);
3) ферритный — стали, имеющие структуру феррита без α ↔ γ-превращений (хромистые стали с 13–30 % Cr, низким содержанием С — до 0,15 %, добавками Ti ≥ 0,5 %, иногда также Nb, Si, Mo, Al).
Коррозионностойкие хромистые стали можно разделить на три группы: с фазовым превращением (мартенситный класс); с частичным фазовым превращением (мартенситно-ферритный класс); без фазовых превращений (ферритный класс).
Механические, физические, коррозионные и технологические свойства, а в соответствии с этим и области применения хромистых сталей зависят от их химического состава и структуры (табл. 10.4, 10.5).
Таблица 10.4
Химический состав (%) хромистых коррозионностойких сталей (ГОСТ 5632–72)
| Сталь | С | Si | Mn | Сr | Ni | Ti | Nb | S | P | |
| Не более | Не более | |||||||||
| Стали мартенситного класса | ||||||||||
| 20Х13 | 0,16–0,25 | 0,8 | 0,8 | 12,0–14,0 | – | – | – | 0,025 | 0,030 | |
| 30Х13 | 0,26–0,35 | 0,8 | 0,8 | 12,0–14,0 | – | – | – | 0,025 | 0,030 | |
| 40Х13 | 0,36–0,45 | 0,8 | 0,8 | 12,0–14,0 | – | – | – | 0,025 | 0,030 | |
| 25Х13Н2 | 0,20–0,30 | 0,5 | 0,8–1,2 | 12,0–14,0 | 1,5–2,0 | – | – | 0,15–0,25 | 0,08–0,15 | |
| 20Х17Н2 | 0,17–0,25 | 0,8 | 0,8 | 16,0–18,0 | 1,5–2,50 | – | – | 0,025 | 0,035 | |
| 95Х18 | 0,09–1,00 | 0,8 | 0,8 | 17,0–19,0 | – | – | – | 0,025 | 0,030 | |
| 09Х16Н4Б | 0,05–0,13 | 0,6 | 0,5 | 15,0–18,0 | 3,5–4,5 | – | 0,05–0,20 | 0,025 | 0,030 | |
| Стали мартенситно–ферритного класса | ||||||||||
| 12Х13 | 0,09–0,15 | 0,8 | 0,8 | 12,0–14,0 | – | – | – | 0,025 | 0,030 | |
| 14Х17Н2 | 0,14–0,17 | 0,8 | 0,8 | 16,0–18,0 | 1,5–2,5 | – | – | 0,025 | 0,030 | |
| Стали ферритного класса | ||||||||||
| 08Х13 | ≤ 0,08 | 0,8 | 0,8 | 12,0–14,0 | – | – | – | 0,025 | 0,030 | |
| 12Х17 | ≤ 0,12 | 0,8 | 0,8 | 16,0–18,0 | – | – | – | 0,025 | 0,035 | |
| 08Х17Т | ≤ 0,08 | 0,8 | 0,8 | 16,0–18,0 | – | 5 · С–0,8 | – | 0,025 | 0,035 | |
| 15Х25Т | ≤ 0,15 | 1,0 | 0,8 | 24,0–27,0 | – | 5 · С–0,9 | – | 0,025 | 0,035 | |
| 15Х28 | ≤ 0,15 | 1,0 | 0,8 | 27,0–30,0 | – | – | 0,025 | 0,035 | ||
Таблица 10.5
Date: 2015-07-25; view: 794; Нарушение авторских прав