
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Соединения азота и фосфора в почве
|
|
Основное количество соединений азота (главным образом это органические соединения) сосредоточено в верхнем слое почвы. Кроме органических соединений (гумусовых веществ, аминокислот, амидов, аминосахаров, гетероциклических соединений и растительных остатков), азот в почве присутствует в виде неорганических компонентов в почвенном воздухе, почвенном растворе и в обменном или фиксированном состоянии входит в состав твердой фазы почв. При газовом обмене с атмосферным воздухом часть почвенного азота теряется. В почвенном воздухе соединения азота представлены молекулярным азотом, аммиаком, гемиоксидом, оксидом и диоксидом азота. Суммарно процесс трансформации неорганических соединений азота в почве можно представить схемой:
Где k1, k2, k3, k4 - константы скоростей соответствующих реакций нитрификации и денитрификации.
Скорости соответствующих реакций зависят от температуры почв, рН, степени аэрации и, следовательно, окислительно – восстановительного потенциала почвенного раствора, содержания влаги, органических веществ и ингибиторов. Реакции нитрификации относятся к реакциям первого порядка, а реакции денитрификации имеют нулевой порядок, поэтому:
d[NH4+ ] / dt = -k1[NH4+]
. d[NO2 - ] / dt = -k1[NH4+] - k2 [NO2 -] + k3 – k4
d[NO3 - ] / dt = k2 [NO2 -] - k3
d[NO2 - + NO + N2O + N2] / dt = k4
Для средних условий почв константы скоростей соответствующих реакций равны: k1 = 0,02ч-1, k2 = 0,04 ч-1, k3 = 0,015 мг • кг-1 (N) • ч -1, k4 = 0,01 мг• кг-1(N)• ч-1. Константа скорости процесса окисления ионов NO2- в нитрат - ионы k2 в 2 раза превосходят константу скорости образования нитрит – ионов k1, поэтому нитриты практически не накапливаются в почве. Значения k3 и k4 в значительной степени зависят от окислительно–восстановительных условий и присутствия ингибиторов в почве.
Литосферная часть глобального кругооборота азота представлена на следующей схеме:
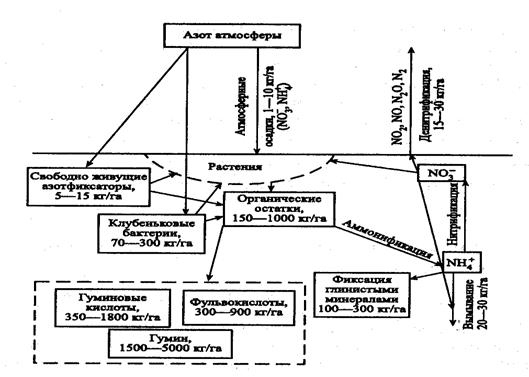
Общее количество фосфора в верхнем слое почвы в среднем составляет 1000 кг /га. Ежегодно с урожаем сельскохозяйственной продукции из почвы выносится 10 – 40 кг/га фосфора. Соединения фосфора в почве содержатся в почвенном растворе, находятся в адсорбированном состоянии на поверхности неорганических компонентов почвы, присутствуют в твердой фазе почв в виде аморфных и кристаллических минералов и входят в состав органических соединений почвы. Основное количество органических соединений фосфора находится в виде сложных эфиров ортофосфорной кислоты и шестиатомного циклического спирта инозита. Трансформация соединений фосфора в почве связана с минерализацией органических фосфорсодержащих веществ, а также с процессами иммобилизации, фиксации и мобилизации его неорганических веществ.
Минерализация – процесс превращения органических соединений фосфора в минеральные.
Иммобилизация – превращение неорганических соединений фосфора в органические в процессе развития живых организмов.
Фиксация фосфора – переход растворимых соединений фосфора в менее
растворимое состояние за счет образования прочных связей с минеральными компонентами почвы.
Мобилизация – увеличение подвижности соединений фосфора, связанное с превращением трудно растворимых соединений в более растворимые.
Фосфатный потенциал (ФП) – используется для оценки возможного перехода фосфатов из твердой фазы почв в почвенный раствор.
ФП = 0,5p(Ca2+) + p (H2PO4-),
Где р(Са2+) = -lg a (Ca2+), p(H2PO4-) = - lg a (H2PO4-.
Если 0,5p(Ca2+) + p (H2PO4-) > - ½ lg Пр(Са(Н2РО4)2),
то концентрация фосфат – ионов в растворе контролируется соединениями, более трудно растворимыми, чем Са(Н2РО4)2.
Если 0,5p(Ca2+) + p (H2PO4-) = - ½ lg Пр(Са(Н2РО4)2),
то растворяется преимущественно монокальцийфосфат.
Date: 2015-07-22; view: 1912; Нарушение авторских прав