
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Влияние температуры на скорость термически активируемых реакций
|
|
Для большинства химических превращений за исключением реакций третьего порядка и ферментативных скорость реакции возрастает с повышением температуры. На качественном уровне представление о масштабе влияния этого фактора на скорость реакции дает эмпирическое правило Вант-Гоффа, согласно которому скорость реакции при повышении температуры на 10K возрастает в 2-4 раза. Если оперировать понятием температурного коэффициента скорости реакции:

то:
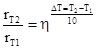
Вант-Гоффом было впервые высказано предположение, что константа скорости, также как и константа равновесия должна экспоненциально изменяться с изменением температуры:

Обоснованием этого является комбинация уравнения изобары химической реакции Вант-Гоффа и идеи Гульдбергу и Вааге о равенстве константы равновесия отношению констант скоростей прямой и обратной реакций:
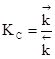
Соответствующие преобразования приводит к:
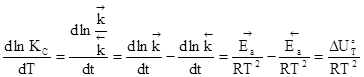
где 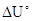 -изменение внутренней энергии для исследуемой реакции, происходящей в условиях постоянства объема реакционной системы;
-изменение внутренней энергии для исследуемой реакции, происходящей в условиях постоянства объема реакционной системы;
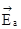 и
и 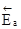 - энергии активации прямой и обратной реакций.
- энергии активации прямой и обратной реакций.
Откуда следует, что в дифференциальной форме уравнение, выражающее зависимость константы скорости от температуры должна иметь вид:
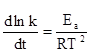
Графическая интерпретация смысла понятия «энергия активации» дает рис.4.1.
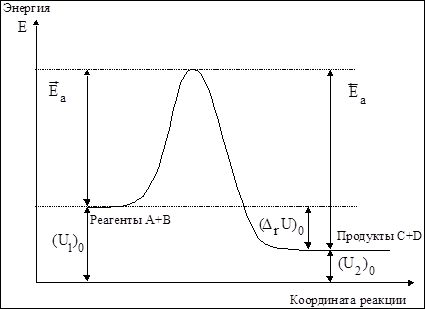
Рис.5.1 Энергетическая диаграмма химической реакции
Как видно, условием осуществления реакции является необходимость преодоления реагирующими частицами некоторого энергетического барьера. Иными словами, для того, чтобы произошла химическая реакция, частицы должны обладать некоторой избыточной по сравнению со средней при заданной температуре энергией. Так как в случае Максвелл-Больцмановского распределения величина средней энергии известна, то энергия активации показывает какой минимальной (в расчете на один моль) энергией должны обладать реагирующие частицы, чтобы вступить в химическое взаимодействие.
Частицы, обладающие энергией ³ Ea, называются активными. В случае Максвелл-Больцмановского распределения доля активных молекул при заданной температуре вычисляется по уравнению:
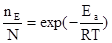
Как видно из табл.4.1 доля активных молекул зависит как от температуры, так и от величины энергии активации. Если доля активных молекул > 10-7 реакции происходят с очень высокими скоростями, если же она <10-16 – то с настолько низкими, что их невозможно измерить. При заданной энергии активации влияние температуры на константу скорости реакции сводится, таким образом, к увеличению доли молекул, обладающих энергией.³ Ea Чем больше величина энергии активации, тем сильнее скорость ее увеличивается с повышением температуры.
Применительно к многостадийным процессам энергия активации отражает совокупное влияние энергетических изменений на всех стадиях и вследствие этого экспериментально определяемую величину принято называть кажущейся (эффективной, эмпирической, Аррениусовской) энергией активацией.
Следует подчеркнуть, что не существует теоретически обоснованной взаимосвязи между энергией активации процесса и соответствующими ему изменениями внутренней энергии и энтальпии, т.е. термодинамическими характеристиками процесса. Но в случае обратимых реакций всегда справедливо равенство:
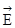 -
- 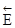 =
= 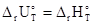
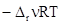

Интегрирование дифференциального уравнения, выражающего температурную зависимость скорости, при допущении, что Ea¹f(T ), приводит к уравнению:
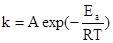
Его принято называть уравнением Аррениуса, который дал экспериментальное подтверждение идеи Вант-Гоффа для большого числа реакций. Коэффициент A в уравнении Аррениуса называют предэкспоненциальным множителем. Размерность его совпадает с размерностью константы скорости. Для реакций первого порядка она имеет размерность частоты [с-1], поэтому предэкспоненту называют также частотным фактором.
Поскольку, согласно основному постулату:
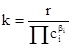
то, учитывая независимость концентрации от температуры в условиях постоянства объема, получаем уравнение для температурной зависимости скорости реакции:
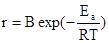
В тех случаях, когда имеются проблемы с нахождением константы скорости, этот уравнение оказывается более удобным для вычисления энергии активации.
Если в рассматриваемом интервале температуру Ea¹f(T), то представление экспериментальных данных в координатах 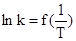 или
или 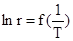 должно приводить к их линеаризации. Наклон получаемой при этом прямой равен отношению
должно приводить к их линеаризации. Наклон получаемой при этом прямой равен отношению 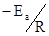 , а отрезок на оси ординат при (1/T)= 0 соответствует
, а отрезок на оси ординат при (1/T)= 0 соответствует 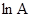 .
.
Для бимолекулярных реакций величина предэкспоненциального множителя может изменяться в довольно широких пределах от 107 до 1012 [дм3моль-1 с-1]. Нормальными, т.е. теоретически ожидаемыми, считаются величины, располагающиеся в диапазоне 1010 – n1011. Вариация значений энергии активации также может быть очень велика. Например, в случае превращений с участием валентно-насыщенных молекул энергия активации близка к энергии разрыва связи и составляет 100-250 кДж/моль. При взаимодействии твердых тел она может достигать 300-400 кДж/моль. Реакции же рекомбинации атомов и свободных радикалов протекают практически с нулевой энергией активации.
Значение температурного коэффициента химической реакции связано с величиной энергии активации уравнением:
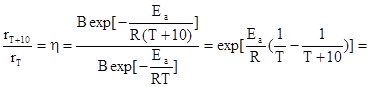
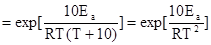
Следовательно, малый диапазон изменения h в правиле Вант-Гоффа обусловлен тем, что в рассмотренном им классе реакций, изученных при температурах, близких к комнатной, величина энергии активации изменялась в сравнительно узком интервале: 50-100 кДж/моль.
Линейность графика, представленного в Аррениусовских координатах, совсем не означает, что мы имеем дело с одностадийной реакцией. Это лишь основание к утверждению, что лимитирующая стадия в рассматриваемом процессе остается неизменной, либо, что константа скорости сложной реакции выражается через произведение или отношение отдельных стадий. Действительно, если:
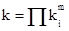
то:
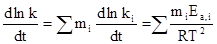
На практике можно столкнуться с ситуацией, когда наблюдаются отклонения от уравнения Аррениуса. Если экспериментальные данные представлены в координатах 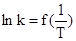 или
или 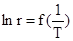 , то это обнаруживается либо по нелинейности зависимости или по наличию двух (но возможно и большего числа) прямолинейных участков разного наклона. Причинами этого могут быть:
, то это обнаруживается либо по нелинейности зависимости или по наличию двух (но возможно и большего числа) прямолинейных участков разного наклона. Причинами этого могут быть:
- зависимость величины предэкспоненциального множителя от температуры;
- постепенное изменение механизма процесса в рассматриваемом интервале температур, что при смене лимитирующей стадии в узком температурном диапазоне приводит к появлению излома на зависимости 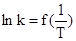 ;
;
- недоучет возможности развития процесса одновременно по нескольким направлениям. и определение константы скорости реакции по концентрации реагента в условиях, когда процесс развивается Простейшим примером этого могут служить параллельные необратимые реакции первого порядка, для которых при наличие двух стадий: k = k1 + k2. Нетрудно убедиться, что, если общая константа скорости является линейной комбинацией констант отдельных стадий, то энергия активации будет функцией температуры.
- Действительно, пусть
k = k1 + k2
тогда:
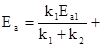
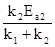
Если константа скорости процесса найдена по изменению со временем концентрации исходного вещества, то найденная величина равна сумме констант скоростей параллельных реакций. Но в этом случае, как видно из записанного выше уравнения, даже при независимости от температуры энергии активации отдельных стадий общая энергия активации будет функцией температуры, поскольку каждая из констант скорости по разному изменяется с температурой, так как Ea1 ¹ Ea2.
Отметим в заключение, что экспериментальное исследование реакций, характеризующихся высокими значениями энергии активации, может привести к получению корректных результатов только при выполнении жестких требований по термостатированию реакционного сосуда. Если, например, температурный коэффициент равен четырем, то погрешность определения скорости реакции при точности поддержания температуры реакционного сосуда ± 1K будет составлять около ±15% (!).
[1]
Date: 2015-07-24; view: 544; Нарушение авторских прав