
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Обратимые реакции. Простейшая обратимая реакция может быть представлена схемой:
|
|
Простейшая обратимая реакция может быть представлена схемой:
A 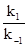 ®B
®B
Дифференциальное уравнение для скорости реакции с учетом принципа независимости элементарных реакций записывается в виде:
rA= - 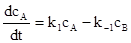
Пусть c0A и c0B равны, соответственно, начальным концентрациям веществ A и B; x – число моль веществ A, вступившего в реакцию в единице обьема к моменту времени t. Тогда текущие концентрации участников реакции будут: c0A -x и c0B+x. С учетом этого уравнение для скорости приобретает вид:
rA= 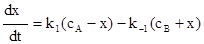
После несложных преобразований [1]получаем:
rA = 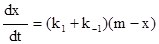
где 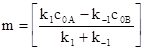 =
= 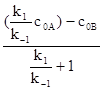
Разделение переменных и интегрирование в пределах 0®x и 0®t:
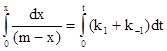
приводит к:
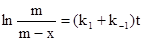
Для нахождения величины m следует принять во внимание, что отношение 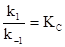 равно концентрационной константе равновесия. Величина KС может быть вычислена из термодинамических данных о стандартных энергиях образования Гиббса участников реакции по уравнению:
равно концентрационной константе равновесия. Величина KС может быть вычислена из термодинамических данных о стандартных энергиях образования Гиббса участников реакции по уравнению:
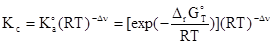
или найдена из экспериментальных данных о составе смеси при бесконечно большой длительности опыта, когда будет достигнуто равновесное состояние. В этом случае:
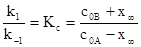
При известном m опытные данные следует представить (или аппроксимировать) в координатах 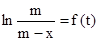 (рис.3.1.а), что приводит к линеаризации результатов эксперимента. При графическом представлении наклон прямой линии равен сумме констант прямой и обратной реакции. Их отношение, как уже отмечалось, может быть найдено из данных о составе равновесной смеси. Комбинация двух уравнений позволяет вычислить порознь каждую из констант.
(рис.3.1.а), что приводит к линеаризации результатов эксперимента. При графическом представлении наклон прямой линии равен сумме констант прямой и обратной реакции. Их отношение, как уже отмечалось, может быть найдено из данных о составе равновесной смеси. Комбинация двух уравнений позволяет вычислить порознь каждую из констант.
На рис.3.1.б,в показаны кинетические кривые, характеризующие накопления продукта и расходование реагента, для случаев, когда KС >1 и KС <1. Следует обратить внимание,  что в любом временном разрезе при равенстве стехиометрических коэффициентов у реагента и продукта справедливо равенство:
что в любом временном разрезе при равенстве стехиометрических коэффициентов у реагента и продукта справедливо равенство:
c0A + c0B = cA + cB
Date: 2015-07-24; view: 453; Нарушение авторских прав