
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Известкование воды
|
|
Известкование производится при обработке исходной воды в осветлителях суспензией гашеной извести Са(ОН)2, называемой известковым молоком. Основное назначение известкования – снижение щелочности обрабатываемой воды. При этом происходит частичное снижение общей жесткости воды, солесодержания, кремнийсодержания, концентрации соединений железа и одновременно из воды удаляются грубодисперсные примеси.
Сущность процесса известкования состоит в том, что при вводе извести достигается повышение рН обрабатываемой воды до значения 9,5 – 10,3, при котором бикарбонаты  и равновесная углекислота СО2 переходят в карбонат-ионы
и равновесная углекислота СО2 переходят в карбонат-ионы 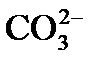 . С учетом присутствия в обрабатываемой воде ионов кальция и образовавшихся карбонат-ионов произведение их концентраций становится больше произведения растворимости по СаСО3, поэтому из воды выделяется труднорастворимый карбонат кальция.
. С учетом присутствия в обрабатываемой воде ионов кальция и образовавшихся карбонат-ионов произведение их концентраций становится больше произведения растворимости по СаСО3, поэтому из воды выделяется труднорастворимый карбонат кальция.
В упрощенном виде при известковании протекают следующие реакции:
1) при вводе извести происходит её диссоциация, приводящая к повышению рН:
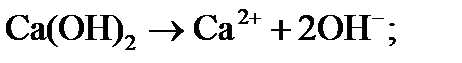 (1)
(1)
2) в воде появляются ионы ОН-, которые связывают свободную углекислоту с последующей диссоциацией по схеме:
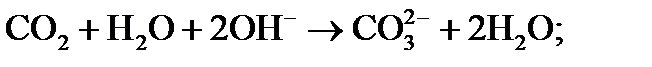 (2)
(2)
3) происходит диссоциация гидрокарбонатных ионов (бикарбонатов), определяющих щелочность воды:
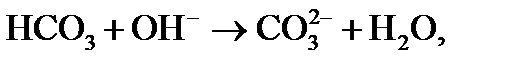 (3)
(3)
причем по реакции (3) из одного одновалентного иона 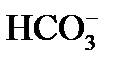 образуется один двухвалентный ион
образуется один двухвалентный ион 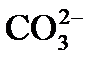 , а в эквивалентных единицах концентрация образовавшихся
, а в эквивалентных единицах концентрация образовавшихся 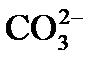 будет в два раза больше концентрации разрушаемых ионов
будет в два раза больше концентрации разрушаемых ионов 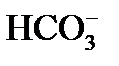 ;
;
4) выделение в осадок почти нерастворимого СаСО3 происходит при достижении произведения растворимости по карбонату кальция, так как в воде есть кальций, содержащийся в исходной воде, введенный с известью, и вновь образованные карбонаты:
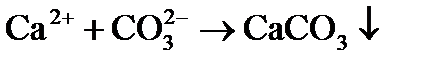 (4)
(4)
5) при превышении дозы извести над её количеством, необходимым для образования карбонатов в воде, появляется избыток ионов ОН- и может быть превышено произведение растворимости по 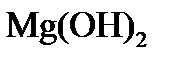 с переводом магния в твердую фазу в виде Мg(ОН)2:
с переводом магния в твердую фазу в виде Мg(ОН)2:
 (5)
(5)
Подсчитаем дозу извести, необходимую для декабонизации, снижения щелочности и переведения ионов Mg2+ в 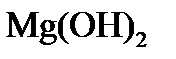 . Ионы ОН- должны вводится в следующих количествах:
. Ионы ОН- должны вводится в следующих количествах:
1) для переведения 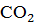 в
в 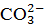 в количестве, эквивалентном исходному содержанию
в количестве, эквивалентном исходному содержанию 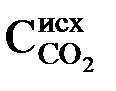 ;
;
2) для перевода бикарбонатных ионов в карбонатные – в количестве, эквивалентном исходной концентрации 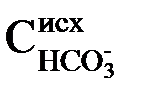 ;
;
3) для переведения ионов Mg2+ в 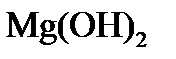 - в количестве, эквивалентном исходной концентрации
- в количестве, эквивалентном исходной концентрации  .
.
Таким образом, ионы 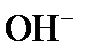 должны быть введены в обрабатываемую воду в дозе:
должны быть введены в обрабатываемую воду в дозе:
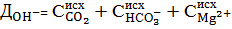 . (6)
. (6)
Одновременно с известью вводятся ионы кальция.
Реакции, протекающие при известковании обратимы, поэтому для их смещения в нужном направлении приходится вводить некоторый избыток Са(ОН)2 в количестве 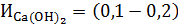 мг-экв/дм3.
мг-экв/дм3.
Поэтому практическая доза извести с учетом избытка равна
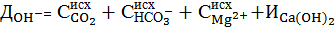 . (7)
. (7)
При совмещении процессов известкования и коагуляции в качестве коагулянта используют обычно сульфат двухвалентного железа в дозировке Дк. На образование гидроксида железа при известковании требуется дополнительный расход извести как источника гидроксид-ионов, что должно учитываться при расчете дозы извести согласно реакции
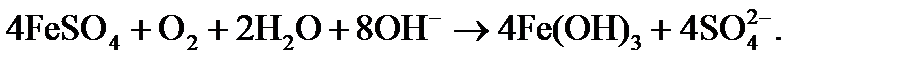
Тогда в формуле (7) следует учесть дозу коагулянта в виде:
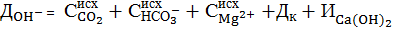 . (8)
. (8)
При расчете дозы извести необходимо учитывать ионный состав обрабатываемой воды. Для практического использования расчетная доза извести Ди, мг-экв/дм3, определяется для большинства типов вод, для которых  Жо + Дк ≥ Щисх – Щобр, по формуле:
Жо + Дк ≥ Щисх – Щобр, по формуле:
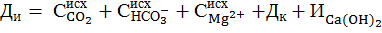 (9)
(9)
Приведенные реакции (1-9) позволяют определить требуемую дозу извести в процессе известкования с дополнительным осаждением магния. Этот режим называется гидратным и происходит при рН = 10,0 – 10,3.
Формула (9) учитывает расход извести на осаждение магния, но во многих случаях осаждение магния не обязательно.
Режим, в котором осаждение магния не происходит или происходит не полностью, называется карбонатным. В этом случае выделяется, главным образом, СаСО3 при рН = 9,5. Возможны два случая ведения этого режима.
Для вод, имеющих отношение 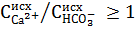 , магний можно не осаждать совсем. Доза извести в этом случае определяется по формуле:
, магний можно не осаждать совсем. Доза извести в этом случае определяется по формуле:
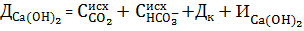 . (10)
. (10)
Контроль режима известкования ведется по значению концентрации кальция в известкованной воде, которая должна быть примерно равна:
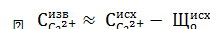 ,
,
где 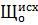 - общая щелочность исходной воды, мг-экв/кг.
- общая щелочность исходной воды, мг-экв/кг.
Для вод, имеющих отношение 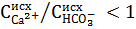 , осаждение магния оказывается неизбежным в количестве (
, осаждение магния оказывается неизбежным в количестве (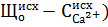 , и доза извести определяется по формуле:
, и доза извести определяется по формуле:
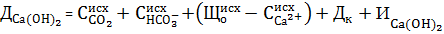 . (11)
. (11)
В карбонатном режиме шлам имеет структуру песка, быстро оседает, но столб жидкости над границей раздела осветляется плохо.
В промышленных условиях вести строгий режим дозирования извести, обеспечивающий отсутствие гидратной щелочности, практически невозможно. Поэтому обычно процесс известкования проводят в гидратном режиме с остаточной гидратной щелочностью, равной 0,1 – 0,3 мг-экв/дм3 (формула 8). В гидратном режиме образуется шлам, имеющий однородную творожную структуру с крупными хорошо осаждающимися хлопьями. К преимуществам гидратного режима известкования относится также то, что присутствие гидроксида магния в осадке способствует снижению кремнийсодержания на 25 – 30 % за счет адсорбции ионов 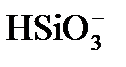 на свежеосажденном гидроксиде магния.
на свежеосажденном гидроксиде магния.
Передозировка извести по отношению к доле выделенного магния Mg2+ при гидратном режиме не сопровождается снижением жесткости и щелочности, а вызывает замену некарбонатной магниевой жесткости на кальциевую по реакции
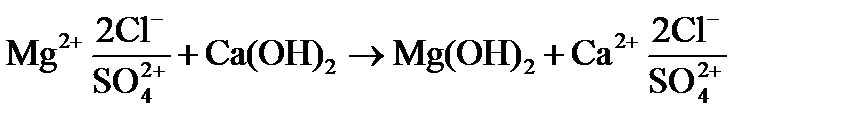
К моменту прохождения всех стадий известкования остаточная карбонатная щелочность (т.е. сумма 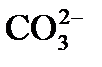 и
и 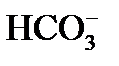 ) обычно составляет 0,5 – 0,8 мг-экв/дм3 в зависимости от кальциевой жесткости известкованной воды.
) обычно составляет 0,5 – 0,8 мг-экв/дм3 в зависимости от кальциевой жесткости известкованной воды.
Ухудшение реальных результатов по щелочности, концентрациям ионов Са2+ (на 0,15 – 0,3 мг-экв/дм3) и Mg2+ (на 0,1 – 0,15 мг-экв/дм3) в процессе известкования по сравнению с равновесными их значениями связывают с влиянием кинетических факторов: достаточно медленной кристаллизацией образующейся твердой фазы СаСО3 и Mg(OH)2 при приближении системы к состоянию равновесия и «тормозящей» роли органических примесей (защитных коллоидов) исходной воды, а также с выносом из осветлителя микрокристаллов твердой фазы.
6. Лабораторная работа № 1
КОАГУЛЯЦИЯ ВОДЫ
М е т о д и к а п р о в е д е н и я р а б о т ы и о б р а б о т к а
р е з у л ь т а т о в о п ы т о в
Работа выполняется в следующей последовательности:
а) выполняются анализы исходной воды согласно методикам аналитического контроля, приведенным в прил. 1: необходимо определить окисляемость, общую жесткость и общую щелочность;
сначала проводят анализ окисляемости, для чего ставят кипятить пробу с исходной водой в термостойкой колбе с добавленными в неё реактивами, засекают время с момента закипания;
пока кипятится проба на окисляемость, проводят анализы исходной воды на общую жесткость и щелочность;
затем заканчивают анализ окисляемости согласно методике;
аналогично выполняется анализ окисляемости для контрольной пробы с дистиллятом;
б) для проведения процесса коагуляции в коническую колбу емкостью 750 мл отбирают 500 мл исходной воды и нагревают её до 40 оС, контролируя температуру нагрева воды лабораторным термометром; по указанию преподавателя корректируют значение рН, добавляя в исходную подогретую воду 0,1 н раствор НCl или 0,1 н раствор NaOH из бюреток в заданном количестве;
в) проводят процесс коагуляции, для чего в воду добавляют дозу коагулянта, указанную преподавателем (1% раствор Al2(SO4)3 или FeSO4); содержимое колбы осторожно перемешивают 5 – 8 минут, затем оставляют в покое в течение 15 - 25 минут;
г) фильтруют коагулированную воду через бумажный фильтр, уложенный в воронку, осторожно сливая отстоявшуюся прозрачную жидкость; к концу фильтрования переносят на фильтр осадок;
д) проводят в коагулированной воде определение окисляемости, общей жесткости и общей щелочности;
е) результаты анализов заносят в отчет.
С о д е р ж а н и е о т ч е т а
Отчет по работе должен содержать:
- описание процесса коагуляции;
- описание условий проведения коагуляции (корректировка рН, доза и тип коагулянта);
- рабочие записи при выполнении анализов воды, в которых указывается методика определения, реактивы, используемые для анализа, расчет результатов титрования;
- результаты анализов оформляются в виде табл. 1;
- выводы, поясняющие эффективность процесса коагуляции;
- ответы на контрольные вопросы.
Таблица 1. Результаты измерений
| Исследуемая вода | Окисляемость | рН | Щелочность, мг-экв/дм3 | Жесткость, мг-экв/дм3 | ||
| мг О2/дм3 | % сни- жения | Общая | Некарбо- натная | |||
| Исходная | ||||||
| После коагуляции |
Некарбонатную жесткость вычисляют по формуле: Жнк=Жо – Жк; карбонатную жесткость Жк принимают равной бикарбонатной щелочности, определенной в результате анализов исходной и коагулированной воды.
К о н т р о л ь н ы е в о п р о с ы
1. Какие примеси природных вод удаляются в процессе коагуляции?
2. Какие коагулянты используются в процессах обработки воды?
3. Почему при использовании коагулянта Al2(SO4)3 необходимо поддерживать определенные значения рН?
4. Как изменяется щелочность воды при коагуляции?
5. Как изменяется жесткость воды при коагуляции?
6. С какой целью воду перед коагулированием подогревают?
7. Для чего применяются флокулянты?
7. Лабораторная работа №2
Date: 2015-07-24; view: 9041; Нарушение авторских прав