
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота №6
|
|
ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ ТА ЕЛЕКТРОЛІЗ
Мета роботи: ознайомитися з основними принципами роботи хімічних джерел електричної енергії, з процесами, що відбуваються при проходженні електричного струму через розчин електроліту.
6.1 Загальні відомості
6.1.1 Електродні потенціали. Гальванічні елементи.
Устрій в якому енергія окисно-відновних реакцій перетворюється на електричну називається гальванічним елементом. При цьому окисно-відновну реакцію необхідно здійснити так, щоб процеси окиснення і відновлення було розділено у просторі і створити можливість перебігу електронів від відновника (анод) до окисника (катод) по зовнішньому провіднику.
Суттєвим для перетворення хімічної енергії на електричну є наявність двох різнорідних провідників з електронною провідністю, занурених у розчин з йонною провідністю (розчини електролітів); ці останні сполучаються між собою напівпроникною перетинкою, соляним або електрохімічним місточком, який необхідний для замикання ланцюжка між двома електродами та забезпечення електронейтральності розчинів. На аноді протікає процес окиснення 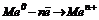 , на катоді – відновлення
, на катоді – відновлення 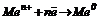 .
.
На межі: метал - розчин (вода, розчин електроліту) виникає подвійний електричний шар і з’являється різниця електричних потенціалів, який заміряти неможливо. Однак можна заміряти різницю потенціалів двох хімічно різних електродів, прийнявши один з них за електрод порівняння, це – електродний потенціал порівняння 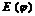 . Звичайно, за електрод порівняння беруть водневий, нульовий електрод, занурений в
. Звичайно, за електрод порівняння беруть водневий, нульовий електрод, занурений в 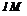 розчин
розчин 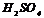 при
при 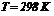 ,
, 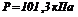 (стандартні умови), його електродний потенціал
(стандартні умови), його електродний потенціал 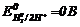 .
.
Різниця потенціалів стандартного водневого електрода та будь-якого електрода за стандартних умов називається стандартним електродним потенціалом 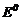 (табличні дані). Значення
(табличні дані). Значення 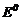 усіх можливих процесів створюють ряд стандартних електродних потенціалів, де вказані
усіх можливих процесів створюють ряд стандартних електродних потенціалів, де вказані 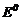 (В) - редокс-потенціали розповсюджених окисно-відновних процесів (Додаток В). Якщо умови процесів відрізняються від стандар-тних, для визначення електродних потенціалів використовують рівняння Нернста:
(В) - редокс-потенціали розповсюджених окисно-відновних процесів (Додаток В). Якщо умови процесів відрізняються від стандар-тних, для визначення електродних потенціалів використовують рівняння Нернста:

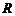 - універсальна газова стала
- універсальна газова стала 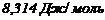 ;
;
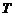 - термодинамічна температура,
- термодинамічна температура, 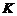 ;
;
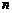 - заряд йону (кількість електронів);
- заряд йону (кількість електронів);
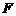 - стала Фарадея
- стала Фарадея 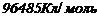 ;
;
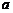 - активність йонів в розчині.
- активність йонів в розчині.
Різниця потенціалів, яка виникає між металом і розчином його солі (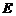 ) може служити мірою його активності. Чим більше від’ємне значення
) може служити мірою його активності. Чим більше від’ємне значення 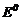 металу, тим він активніший, чим більша різниця в значеннях
металу, тим він активніший, чим більша різниця в значеннях 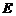 між електродами, що створюють гальванічний елемент, тим більша його електрорушійна сила:
між електродами, що створюють гальванічний елемент, тим більша його електрорушійна сила:
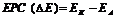
| 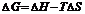
|
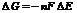
| 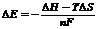
|
6.1.2 Електроліз
Процес протікання окислювально-відновних реакцій під дією постійного електричного струму в розчинах або розплавах електролітів називається електролізом.
На катоді протікають процеси відновлення:
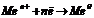
| 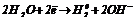
|
На аноді протікають процеси окиснення:
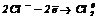
| 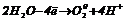
|
Для розповсюджених катіонів існує такий ряд розрядження на катоді:
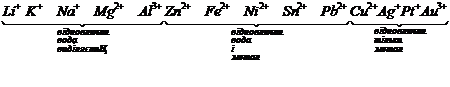 Для розповсюджених аніонів – ряд розрядження на аноді:
Для розповсюджених аніонів – ряд розрядження на аноді:
легко розряджаються 
важко розряджаються 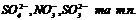
Кількісною характеристикою електролізу є закони Фарадея (1833р): І · τ = m/Мекв·F, де
І – сила струму, А;
τ – час, с;
m – маса речовини, г;
Мекв – молярна маса еквівалента, г/моль;
F – стала фарадея.
νА/νВ=ZА/ZВ, де
νА,νВ – кількість речовин А і В
ZА/ZВ – еквівалентні числа речовин А і В
Практично маси (об’єми) речовин, виділених на електродах менші від розрахованих за законами Фарадея, внаслідок перенапруги, яка виникає з різних причин. Розраховують величину η – вихід за струмом
| η= mпракт/mтеор ·100% | η= Vпракт/Vтеор ·100% |
Найбільший вихід за струмом мають легко розряджу- вальні метали Cu, Ag, Au та ін.
6.2 Завдання для самостійного розв’язання
6.2.1. Відповісти на запитання.
1. Пояснити вираз: «окисно- відновні реакції можуть бути як джерелами, так і споживачами електричного струму».
2. Чому практичні значення ЕРС гальванічного елемента, маси (об’єми) речовин, що виділяються на електродах при електролізі, відрізняються від теоретично розрахованих?
3. Охарактеризувати практичне використання процесів, які протікають в гальванічних елементах,при електролізі.
6.2.2. Розв’язати задачі.
1. У дві склянки з блакитним розчином мідного купоросу помістили: до першої пробірки - цинкову пластинку, до другої - срібну. У якій склянці і чому колір розчину поступово зникає?
Скласти молекулярні та електронні рівняння відповідних реакцій, струмоутворюючу реакцію, схему гальванічного елементу, розрахувати ЕРС з використанням стандартних значень електродних потенціалів. (1,1В)
2. Скласти схему гальванічного елемента, робота якого ґрунтується на реакції.
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Написати електронні рівняння анодного та катодного процесів. Обчислити ЕРС цього елемента, якщо [ Ni2+ ]=0,01мол/л, [ Pb2+ ]=0,0001мол/л. (0,061В)
3. Розрахувати масу речовини, яка виділиться на катоді, масу та об’єм виділеної речовини на аноді, якщо через розчин аргентум нітрату пропускали струм силою 2А на протязі 5 годин. Скласти електронні рівняння процесів на катоді та аноді. (40,3г; 2,99г; 2,09л)
6.2.3 Виконати завдання
6.2.3.1 Гальванічний елемент
Для даного гальванічного елемента виконати:
1. Визначити який з двох електродів може бути анодом, який катодом (стандартні умови)? Чому?
2. Записати процеси, які протікають на аноді та катоді у працюючому гальванічному елементі;
3. Записати струмоутворюючу реакцію;
4. Скласти схему гальванічного елемента;
5. Визначити е.р.с. гальванічного елемента за стандартних умов та при концентрації йонів на аноді 0,01 моль/л.
6.2.3.2 Електроліз водних розчинів
1. Скласти схеми процесів, які протікають при електролізі водного розчину даної речовини з даними електродами.
2. Розрахувати маси речовин, які утворюються, якщо електроліз буде проходити при силі струму І (А) протягом певного часу Δt (год).
| № варіан-ту | Гальва-нічний елемент | Електроліз | |||
| Речовина | Електрод | І(А) | Δt(год) | ||
| Fe/Ni | FeCl3 | Pt | 2 | 1 | |
| Mg/Zn | KCl | C | 1,5 | 2 | |
| Co/Ag | ZnBr2 | Pt | 3 | 1,5 | |
| Pb/Cu | CaI2 | C | 2 | 3 | |
| Al/Co | FeSO4 | Fe | 4 | 2 | |
| Mn/Ni | HNO3 | C | 3 | 4 | |
| Cd/Zn | KOH | C | 4 | 2 | |
| Ag/Cr | CdSO4 | Pt | 1,5 | 3 | |
| Cd/H2 | H2SO4 | Pt | 2 | 1,5 | |
| Cu/Fe | Mg(NO3)2 | C | 3 | 3 | |
| Ni/Al | NaOH | C | 4 | 4 | |
| Mg/Sn | AgNO3 | Ag | 2 | 5 | |
| Fe/H2 | Hg(NO3)2 | C | 5 | 3 | |
| Mg/Cd | FeCl2 | Fe | 1 | 5 | |
| Co/Zn | NaNO3 | C | 5 | 2 | |
| Ag/Al | FeBr3 | Pt | 4 | 1,5 | |
| Pb/Mn | RbCl | C | 0,5 | 3 | |
| Ni/Cu | Cr2(SO4)2 | Cr | 1,5 | 0,5 | |
| H2/Al | AuCl3 | Au | 2 | 2 | |
| Cr/Mn | Co(NO3)2 | C | 0,5 | 0,5 | |
| Fe/Ag | TiCl3 | C | 3 | 2,5 | |
| Sn/Li | Bi(NO3)2 | Pt | 2,5 | 3 | |
| Cd/Hg | NiCl2 | Ni | 5 | 5 | |
| Sn/Cr | CsBr | C | 2,5 | 2,5 | |
| Co/Pb | BaCl2 | Pt | 0,7 | 0,7 |
Date: 2015-07-23; view: 795; Нарушение авторских прав