
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Розчини
|
|
Мета роботи: вивчити загальні властивості розчинів, дати порівняльну характеристику розчинам електролітів та неелектролітів, навчитися здобувати розчини заданої концентрації.
5.1 Загальні відомості
5.1.1. Загальна характеристика розчинів
Розчини - гомогенні системи, які складаються з двох або більше компонентів: дисперсійної фази – речовини, які рівномірно розподілені у вигляді молекул, атомів, йонів у дисперсійному середовищі – розчиннику. Розчинення речовин супроводиться зміною теплового ефекту. Цей факт та інші свідчать про хімічну взаємодію розчиненої речовини та розчинника.
При розчиненні речовини протікають процеси: руйнування хімічних зв'язків між частинками (атомами, молекулами, йонами) речовини, розчинника, що пов'язане з поглинанням теплоти; в цей час відбувається екзотермічний процес утворення сольватів (гідратів); дифузія сольватів (гідратів) між частинками розчинника (ендотермічний процес). Тепловий ефект розчинення - це сумарне значення вище вказаних процесів.
Розчинність речовини залежить від: природи речовини, температури, тиску (для газоподібних речовин) та інші. (Додаток Г).
Кількісно розчини характеризуються:
1. Кр - коефіцієнт розчинності, показує масу речовини, що припадає на 100 г розчинника (об'єм газоподібної речовини на 1 л розчинника)
2. ω - масова (об'ємна) частка розчиненої речовини
| ω = (mреч./mр-ну.)·100%; | ω = (Vреч./V р-ну.) ·100%. |
3. См - молярна концентрація, показує кількість розчиненої речовини, яка міститься в 1 л розчину
| СМ = υ/ Vр-ну | СМ = m/(M· Vр-ну), моль/л |
4. СN - еквівалентна концентрація (нормальна) показує число еквівалентів (Nекв .) розчиненої речовини в 1 л розчину.
СN = Nекв/Vрозч.; СN=m/(Mекв · Vрозч.)
5. Титр - відношення маси речовини до об'єму розчинника
T = mреч./Vрозч.(мл)
5.1.2. Розчини електролітів
1. При розчиненні у воді електроліти дисоціюють з утворенням йонів, тому розчини електролітів проводять електричний струм.
HCl ↔ H+ + Cl-; Al2(SO4)3 ↔ 2Al3+ +3SO42-;
NaOH ↔ Na+ + OH-; KHCO3 ↔ K+ + HCO3
2. На процес дисоціації впливає: природа речовин, природа розчинника, температура.
3. Кількісною характеристикою процесу дисоціації є:
1) ступінь дисоціації (α)
α=СM. дис. м-л /СМ заг.;
Ступінь електролітичної дисоціації визначають експериментально за величиною ізотонічного коєфіціента і -поправлення від ідеальних систем, розбавлених розчинів неелектролітів
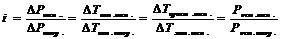
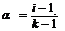 , k - число йонів, на яке дисоціює молекула електроліту.
, k - число йонів, на яке дисоціює молекула електроліту.
2) для слабких електролітів - константа дисоціації КД.
Для рівняння: aA + bB = cC + dD
KД = (Ссс·СDd)/(CAa·CBb); KД = Сα2/1-α (закон розбавлення Оствальда).
4. Дисоціація води. Йонний добуток води.
Чиста вода - слабкий електроліт.
Н2О ↔ H+ + OH- α=1,8·10-9 (22°C)
2H2O ↔ H3O+ + OH-; H3O+ - йон гідроксонію
КН2О = [H+] · [OH-] - йонний добуток води.
В 1 л води (t° = 22°С) [H+] = [OH-]=10-7 йонів
КН2О=10-7·10-7=10-14 - стала величина
Кислотні властивості розчинів (С.Серенсен,1909р) характеризуються величиною водневого показника рН = -lg [H+].
рН = від 1 до 14
рН = 7 - нейтральний розчин
рН < 7 - кислий
рН > 7 - лужний
5. Деякі солі при розчинені у воді підлягають гідролізу - розкладаються водою з утворенням слабких електролітів.
Zn2+ + HOH → ZnOH+ + H+; pH < 7
CO32- + HOH → HCO3-+ OH-; pH > 7
Збільшення температури сприяє прискоренню гідролізу.
5.1.2. Розчини неелектролітів
Розчини неелектролітів не проводять електричний струм, характеризуються колегативними властивостями, тобто властивості розчинів залежать лише від їхньої концентрації і не залежать від природи розчиненої речовини.
Кількісно характеризуються:
1) осмотичним тиском (Вант-Гофф, 1885р)
Pосм.= υRT/Vр-ну
2) законами Рауля:
ΔP = P0·(υреч./ (υреч. + υр-ка)
ΔP - відносне зниження тиску пари над розчином
υ - кількість речовини
ΔТкип = Ke·Cm; ΔТкрист = Kкр · Cm
ΔТкип - підвищення температури кипіння розчину в порівнянні з температурою кипіння розчинника;
ΔТкрист. – зниження температури замерзання розчину в порівнянні з температурою замерзання розчинника;
Cm - моляльна концентрація розчину (показує кількість речовини (число молів) в 1000г розчинника)
Ке - константа ебуліоскопічна
Ккр. - константа кріоскопічна
Ке, Ккр - залежать від природи розчинника
5.2 Завдання для самостійного розв'язання
5.2.1. Відповісти на запитання, виконати завдання
1. Дати характеристику дисперсійним системам.
2. Порівняти властивості та кількісну характеристику розчинів електролітів та неелектрлітів.
3. Привести приклади рівнянь реакції обміну (в молекулярному та йонному виглядах) з утворенням нерозчинної речовини, газоподібної речовини, слабкого електроліту.
4. Скласти рівняння реакцій гідролізу солей FeCl3, K2CO3, CH3COONH4. Вказати pH середовища.
5.2.2 Розв'язати задачі
1. Визначити ω, См, СN розчину сульфатної кислоти, якщо в 24,5 г розчину міститься 4,9 г H2SO4, ρр-ну = 1,139 г/см3
(20%, 2,325 М, 4,65 N)
2. Визначти pH 0,01М розчину хлоридної кислоти.
(2)
3. Визначити масу 98%-ного розчину сульфатної кислоти, необхідну для приготування 500г 25%-ного розчину
(127,6г)
Date: 2015-07-23; view: 493; Нарушение авторских прав