
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота №8
|
|
ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ ТА ЇХ СПОЛУК
Мета роботи: ознайомитися з деякими методами здобування, властивостями металів та їх сполук.
8.1. Загальні відомості
1. Метали хімічні елементи, характерною особливістю будови їх атомів є наявність одного, двох, трьох електронів на зовнішньому енергетичному рівні:
ns1-2, ns2np1-2, ns2(n-1)d1-10, ns2(n-2)f1-14, де n - зовнішній енергетичний рівень, (n-1)- передостанній, (n-2) – третій від кінця енергетичний рівень.
2. Частіше всього метали відновники:
Ме0 – nеˉ → Меn+
3. В сполуках можуть проявлятись ступені окислення від +1 до +8.
Сполуки, де Ме+1, Ме+2, як правило йонні, їх оксиди та гідроксиди мають основний характер властивостей.
Сполуки, де Ме+3,Ме+4 - йоно-ковалентні, їх оксиди та гідроксиди мають амфотерні властивості.
Сполуки, де Ме+5, Ме+6, Ме+7, Ме+8 – ковалентні, їх оксиди та гідроксиди мають кислотні властивості.
4. Металом називається особливий стан простої конденсованої речовини, в кристалічній гратці якої вільно переміщуються електрони за принципами квантової механіки. Метали тверді (крім Нg), тепло-, електропровідні, ковкі, пружні, мають металічний блиск. Температура плавлення металів змінюється в широкому інтервалі: від -38,9 0С (Нg) до 3420 0С (W). Найвищу температуру плавлення в кожному періоді мають метали, електронна конфігурація валентних електронів відповідає формулам:
ns2(n-1)d3; ns2(n-1)d4
За густиною метали поділяються на легкі, їх густина до 5·103 кг/м3 (Mg, Al, Ti, Be), важкі – їх густина більша за 5·103 кг/м3 .
5. В природі знаходяться:
а) у вільному стані (Au, Cu, Pt …)
б) у вигляді оксидів (Fe2O3 -гематит, Al2O3 - корунд)
в) у вигляді солей та кристалогідратів (NaCl -камяна сіль, CaSO4·2H2O - гіпс).
г) поліметалічних руд (Се, La…)PO4 - монацит.
6. Здобувають метали металургійними способами:
а) пірометалургійний (відновники - С, СО, Н2, Al, Ca)
Fe2O3 + 3C = 2Fe + 3CO
б) гідрометалургійний
CuSO4 + Fe = FeSO4 + Cu; Cu2+ + Fe0 = Cu0 + Fe2+
в) електрометалургійний
2NaCl = (ел-з розплаву) 2Na +Cl2
7. Хімічна активність металів виявляється у здатності металу віддавати електрони. Метали, які на зовнішньому енергетичному рівні мають один електрон (ns’, IA підгрупа)- лужні метали хімічно-активні, активність збільшується із збільшенням атомного радіусу (Ra).
8. Метали реагують між собою та неметалами, утворюючи бінарні сполуки: оксиди СаО, гідриди (NaH), карбіди (Al4C3), нітриди (TiN), силіциди (Ca2Si), бориди (К3В), інтерметалічні сполуки. Карбіди, нітриди – тверді, тугоплавкі матеріали.
9. Активні метали реагують з водою:
2Na + 2H2O = 2NaOH + H2
Fe + H2O(пар) = FeO + H2
Однак деякі метали при взаємодії з водою пасивуються, покриваючись оксидною плівкою (Zn, Al, Mg, Cr).
10. Усі метали, які мають від’ємне значення стандартного електродного потенціалу (Е0 < 0) витісняють водень із кислот – не окисників (HCl, H2SO4(розв)).
Ме0 + nH+ = Men+ + (n/2)H2
З кислотами-окисниками метали реагують по-іншому, продуктами відновлення буде не водень.
| Кислота | Окисник | Продукти відновлення | Які метали взаємодіють |
| H2SO4 кон. | S+6 | SO2 H2S, S | Малоактивні метали, Fe, Co, C,r Al - пасивуються. Активні метали. |
| HNO3 розв. | N+5 | NO N2, NH4NO3 | Малоактивні метали Активні метали (в РСm ЕП до Cr) |
| HNO3 конц. | N+5 | NO2 N2O | Малоактивні метали крім Au, Pt, Al, Fe, Co, Ni пасивуються. Активні метали (в РСm ЕП до Cr) |
Zn + 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O
Zn + H2SO4 (розв.) = ZnSO4 + H2
Zn + 4HNO3 (конц.) = Zn(NO3)2 +2NO2 + 2H2O
8.2. Завдання для самостійного розв’язання
8.2.1. Відповісти на запитання, виконати завдання.
1. В чому полягає сутність загальних фізичних, механічних властивостей металі?
2. Що таке сплави, інтерметалічні сполуки? Як їх здобувають?
3. Хром у сполуках проявляє ступені окислення +2, +3, +6. Як залежить характер властивостей оксидів та гідроксидів хрому від ступеня окиснення. Відповіді підтвердити рівняннями реакції.
4. Скласти рівняння реакції в молекулярному, йонному, де можливо, в електронному видах для здійснення перетворень.
NaH → NaOH →Cu(OH)2 → CuO → Cu
 Na
Na
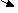 NaNO3 → NaNO2 → NaNO3
NaNO3 → NaNO2 → NaNO3
8.2.2 Розв’язати задачі.
1. Скільки марганцю можна здобути алюмінотермічним способом із 57т піролюзиту (MnO2), який містить 20% пустої породи? Скласти відповідні рівняння реакції здобування марганцю. (28,83т)
2. Визначити об’єм 0,5N розчину нітратної кислоти, який необхідно взяти для повного розчинення 12,8г міді. Скласти рівняння реакції в молекулярному та електронному видах.
(1,07л)
3. Визначити відсотковий вміст доломіту CaCO3•MgCO3 в руді, якщо при прожарюванні 40г руди виділилося 8,96л CO2 (н.у.)
(92%)
8.2.3 Виконати завдання
Скласти необхідні формули, рівняння реакцій в молекулярній, йонній, електронній формах, назвати речовини.
| № ва-ріанту | Елек-тронна будова атома металу | Спосо-би здобування металу | Хімічні власти-вості металу | Загальна характер-ристика оксидів металу | Загальна характер-ристика гідрокси-дів металу | Взаємодія металу з кислотою окисником |
| Li | Au | Zn | Al | Cd | Mg + H2SO4(к) | |
| K | Hg | Mn | Ti | Co | Na + HNO3(к) | |
| Ba | Cu | Ti | Mn | Sn | Ca + HNO3(р) | |
| Sr | Bi | Al | Zn | Ni | Li + H2SO4(к) | |
| Ca | Pb | Be | Cr | Bi | Ba + HNO3(к) | |
| Na | Ni | Mg | Fe | Pb | K + HNO3(р) | |
| Mg | Sn | Na | Cd | Cu | Ca + H2SO4(к) | |
| Be | Co | Ca | Sn | Hg | Pt + HNO3 + HCl | |
| Al | Cd | Sr | Co | Tl | Fe + HNO3(р) | |
| Ti | Fe | Ba | Ni | Cs | Cu + HNO3 + HBr | |
| Mn | Cr | K | Pb | Fe | Bi + HNO3(р) | |
| Zn | Mn | Li | Bi | Cr | Sn + HNO3 + HCl | |
| Cr | Zn | Pt | Cu | Mn | Ga + H2SO4(к) | |
| Fe | Ti | Tl | Hg | Zn | La + HNO3(р) | |
| Cd | Al | Au | Tl | Ti | Pd + HNO3(к) (t°) | |
| Co | Be | Hg | Au | Al | Ag + HNO3 + HCl | |
| Sn | Mg | Cu | Pt | Be | Sn + HNO3(к) | |
| Ni | Na | Bi | Li | Mg | Pb + H2SO4(к) (t°) | |
| Pb | Ca | Rb | La | Na | Bi + HNO3 + HCl | |
| Bi | Sr | Ni | Ba | La | Sc + HNO3(р) | |
| Cu | Ba | Sn | Sr | K | Rh + HNO3 + HCl | |
| Hg | K | Co | Ca | Sr | Ac + HNO3(р) | |
| Tl | Li | Cd | Na | Ba | V + HNO3 + HCl | |
| Au | Ag | Fe | Mg | Li | Ti + HNO3(к) | |
| Pt | Cs | Cr | Be | Rb | V + HNO3(к) |
Date: 2015-07-23; view: 556; Нарушение авторских прав