
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Исследование коагуляционного гемостаза
|
|
Наиболее общее представление о коагуляции дает время свертывания цельной крови.
Весьма простым и удобным является метод Моравица:
на часовое стекло наносят каплю крови, взятой из пальца или мочки уха, диаметром 4–6 мм. Тонким запаянным стеклянным капилляром (концом пастеровской пипетки) проводят каждые 30 с по поверхности капли. Время свертывания определяют в момент появления первых фибриновых нитей, тянущихся за капилляром.
В методе Ли–Уайта используют венозную кровь. Пробирку с 1 мл венозной крови устанавливают на водяной бане при 37 °С и включают секундомер. Через каждые 30 с пробирку наклоняют на 45°. Время от момента забора крови до появления сгустка является временем свертывания крови. У здоровых людей время свертывания цельной крови составляет 5–8 мин.
Общую оценку конечного этапа свертывания крови дает тромбиновое время, т. е. время свертывания цитратной плазмы крови обследуемого лица под влиянием стандартной дозы тромбина.
Метод Сирмаи в модификации Рутберг. В пластиковую пробирку вносят 0,1 мл исследуемой плазмы крови, добавляют 0,1 мл прогретого до 37 °С изотонического раствора хлорида натрия и инкубируют смесь в течение 60 с при 37 °С. Затем вносят 0,1 мл стандартизованного раствора тромбина (раствор тромбина такой активности, который в смеси с равным объемом донорской плазмы вызывает свертывание последней за 15 с), включают секундомер и отмечают время свертывания плазмы крови. В норме тромбиновое время 14–16 с.
Удлинение тромбинового времени может быть связано с выраженной гипофибриногенемией, молекулярными аномалиями фибриногена (см. ниже); избытком в крови гепарина и других антитромбинов; накоплением в крови продуктов деградации фибриногена (ПДФ), оказывающих антитромбиновый эффект, блокирующих фибриноген и фибрин-мономеры с нарушением их полимеризации; парапротеинемией с адсорбцией патологических белков на факторах свертывания и препятствием полимеризации фибрина.
Метод определения фибриногена по Рутберг. К 1 мл плазмы крови добавляют 0,1 мл 10%-ного раствора хлорида кальция и 0,1 мл раствора тромбина (активность 15 с). Образовавшийся сгусток переносят на обеззоленный бумажный фильтр и просушивают другим фильтром до состояния, пока на фильтре не останется влажного пятна. Взвешивают сухой фибрин на торсионных весах. В норме масса сухого фибрина 9–12 мг. Для расчета концентрации фибриногена в плазме крови массу сгустка умножают на экспериментально установленный коэффициент 22,2. В норме концентрация фибриногена в крови равна 0,2–0,4 г в 100 мл.
Для выявления заблокированных ПДФ фибриногена и фибрин-мономеров, что характерно для диссеминированного внутрисосудистого свертывания (ДВС-синдром), применяют так называемые паракоагуляционные пробы (этаноловый, протамин-сульфатный, бета-нафтоловый) и тесты с протеазами из некоторых змеиных ядов. С методикой выполнения их можно познакомиться в специальной литературе.
Снижение активности (дефицит) фибриназы (фактор XIII) не отражается на тромбиновом времени. Для его выявления исследуют растворимость образовавшихся сгустков фибрина в 5 М мочевине и 1%‑ном растворе монохлоруксусной кислоты. Сгустки, не стабилизированные фактором XIII, быстро лизируются, в то время как стабилизованные сгустки устойчивы к данным растворителям.
Если конечный этап свертывания не нарушен (тромбиновое время нормальное), то раздельно оценивают внешний и внутренний механизмы активации свертывания (формирование протромбиназы, трансформирующей протромбин в тромбин).
Внешний механизм суммарно оценивают с помощью теста протромбинового времени по Квику (времени свертывания рекальцифицированной нитратной плазмы при добавлении к ней тканевого тромбопластина стандартизованной активности).
Метод Квика. В пробирку вносят 0,1 мл испытуемой плазмы крови, 0,1 мл суспензии тромбопластина (активность тромбопластина тестируется на нормальной донорской плазме) и ставят в водяную баню при 37 °С на 60 с. Затем приливают 0,1 мл 0,025 М хлорида кальция и включают секундомер. Отмечают время свертывания крови. Опыт повторяют 2–3 раза и определяют средний арифметический показатель.
Протромбиновое время при стандартизованном тромбопластине в норме составляет 12–15 с. Поскольку могут быть отклонения в активности отдельных серий тромбопластина, то прибегают к вычислению протромбинового индекса по формуле:
Протромбиновый индекс = 
где А – протромбиновое время плазмы крови донора; Б – протромбиновое время исследуемого лица. В норме этот показатель равен 80–100 %.
При нормальном тромбиновом времени нарушения внешнего механизма могут быть обусловлены дефицитом факторов VII, X, V или II, поскольку все они определяются протромбиновым временем.
Внутренний механизм формирования активного тромбина включает факторы XII, XI, IX, VIII, X, V, II, но из них три последние оцениваются протромбиновым временем, поэтому при нормальном тромбиновом и протромбиновом времени нарушения внутреннего механизма свертывания зависят только от факторов XII, XI, IX и VIII. Для оценки внутреннего пути активации свертывания крови используют общие коагуляционные тесты: время свертывания цельной крови, парциальное (частичное) тромбопластиновое время (или каолин-кефалиновое время), аутокоагуляционный тест.
Активированное частичное тромбопластиновое время (АЧТВ) время рекальцификации бедной тромбоцитами плазмы крови в стандартных условиях, создаваемых внесением коалина – (активатора XII фактора) и кефалина (аналога 3 тромбоцитарного фактора), для исключения влияния тромбоцитов на результат исследования (метод Proctor с соавт.).
В пластиковую пробирку вносят 0,1 мл бедной тромбоцитами нитратной плазмы, 0,1 мл эритрофосфатида и 0,1 мл коалина, подогретого до 37 °С, смешивают и инкубируют при 37 °С в течение 2 мин. Добавляют 0,025 М хлорида кальция равного объема (0,1 мл), прогретого до 37 °С, и включают секундомер. Отмечают время образования сгустка. В норме активированное частичное тромбопластиновое время составляет 35–45 с.
Аутокоагуляционный тест (АКТ) (по Беркарду с соавторами).
Стандартизация фосфолипидной и контактной активации начальной фазы процесса свертывания осуществляется добавлением к рекальцифицированной плазме крови гемолизата эритроцитов исследуемого больного (аутотест).
По данным, полученным через 2–6–8–10–20–30–40–50–60 мин после добавления гемолизат-кальциевой смеси, строят график, восходящая часть которого отражает динамику нарастания активности тромбопластина и тромбина, нисходящая часть – скорость инактивации тромбина за счет антитромбинов и продуктов фибринолиза.
Чувствительность метода зависит от гематокритного показателя и содержания эритроцитов у больного.
Нарушение только внутреннего механизма активации свертывания крови (при нормальном тромбиновом и протромбиновом времени) предполагает (с учетом соответствующей клинической картины) дефицит факторов VIII или IX, болезнь Виллебранда либо дефицит факторов XI и XII. Нарушение только протромбинового времени при нормальных показателях внутреннего механизма свертывания и нормальном тромбиновом времени предполагает дефицит фактора VII. Нарушение обоих механизмов активации свертывания (при нормальном тромбиновом времени) отмечается либо при наследственном дефиците факторов X, V, II, либо при нарушении их синтеза в печени.
Для уточнения конкретного фактора, дефицит которого мог вызвать обнаруженные нарушения гемокоагуляции, проводят дифференцировочные тесты, основанные на коррекции (исправлении) дефектов свертывания при добавлении либо компонентов крови с заведомо известным недостатком того или иного фактора свертывания, либо ферментных препаратов (змеиных ядов, стафилокоагулазы).
Наряду с изучением коагуляционных механизмов проводят исследование антикоагуляционного звена системы свертывания крови и фибринолитической системы.
Представление о фибринолитической активности крови дает ее определение эуглобулиновым методом.
Метод Ковальского (осаждение в кислой среде и при низкой температуре эуглобулиновой фракции, содержащей факторы свертывания крови и фибринолиза, главным образом плазминоген): 0,1 мл оксалатной плазмы (1:9) помещают в центрифужную пробирку, добавляют 1,8 мл кислой воды (рН 5,2). Пробирку ставят в холодильник при 4 °С (при этом из плазмы выпадает эуглобулиновая фракция). Через 30 мин пробирку вынимают и центрифугируют в течение 10 мин при 2000 об/мин. Надосадочную жидкость отсасывают, к осадку добавляют 0,1 мл бората натрия и ставят в термостат при 37 °С на несколько минут до полного растворения осадка. Добавляют 0,1 мл раствора хлорида кальция (содержащийся в эоглобулиновой факции фибриноген превращается в фибрин), засекают время образования сгустка и вновь ставят пробирку в термостат до полного лизиса сгустка.
Время от момента образования сгустка до его растворения выражает фибринолитическую активность крови, которая в норме равна 3‑4 ч.
В последние годы стали применять более информативные, чем эуглобулиновый, методы исследования фибринолиза, основанные на дополнительной стандартизованной активации его стрептокиназой, а также методы выявления в плазме крови продуктов фибринолиза – ПДФ (иммунологические и химические) и их соединений с фибрин-мономерами и фибриногеном (паракоагуляционные пробы), методы исследования неферментативного фибринолиза по Б. А. Кудряшову. Повышение в плазме крови ПДФ и их соединений с фибрин-мономерами и фибриногеном указывает на происходящее в организме внутрисосудистое свертывание крови и активацию фибринолиза, причем блокада фибриногена и полимеризации фибрин-мономеров продуктами фибринолиза обусловливает наряду с потреблением ряда факторов свертывания крови развитие стадии гипокоагуляции при ДВС-синдроме.
Из физиологических антикоагулянтов имеет значение определение уровня в крови антитромбина III – для выявления наследственной недостаточности (семейные случаи рецидивирующих тромбоэмболий), при ДВС-синдроме и оценке ожидаемого эффекта от гепаринотерапии, поскольку антикоагулирующее действие гепарина реализуется через антитромбин III.
Исследование
микроциркуляторно-тромбоцитарного гемостаза
Наиболее общими тестами, отражающими состояние сосудисто-тромбоцитарного гемостаза, являются определение длительности кровотечения по Дуке и ретракция кровяного сгустка.
Уколочная проба Дуке. При уколе кончика пальца или мочки уха иглой на глубину 3—4 мм выступающую самостоятельно из ранки кровь снимают фильтровальной бумагой каждые 30 с. Продолжительность кровотечения в норме не превышает 4 мин, при тромбоцитопениях удлиняется до 20–30 мин и больше.
Определение ретракции кровяного сгустка. В градуированную центрифужную пробирку помещают 2 мл венозной крови, закрывают пробкой с якорем и переворачивают на 45°, оставляют при комнатной температуре, периодически наклоняя и фиксируя момент, пока кровь не перестанет стекать кровь с якоря и не свернется.
Пробирку устанавливают в водяную баню при 37 °С пробкой вниз на 2 часа. Спустя это время пробирку переворачивают, ставят в штатив, осторожно, не вынимая пробки, вращательными движениями отделяют сгусток, закрепившийся на якоре. Затем пробирку снова ставят в штатив на 10–15 минут. После этого пробку с укрепившимся на ней сгустком удаляют, а пробирку с жидкой кровью центрифугируют 15‑20 минут при 1500–2000 об/мин. По делениям пробирки раздельно учитывают объем сыворотки и форменных элементов крови.
Расчет показателей:
Имея показатели гематокрита, расчитываем спонтанный фибринолиз (СФ), ретракцию (Р) и гемостатические свойства сгустка (V, S, J, T) по следующим формулам:
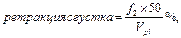
где f2 – объем сыворотки в мл из 2 мл взятой крови; Vpl – объем плазмы (л/л);
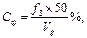
где f3 – объем форменных элементов в мл из 2 мл крови; Vg – объем форменных элементов (л/л);
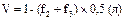

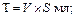
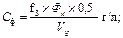

Из проб на резистентность капилляров при тромбоцитопениях и тромбоцитопатиях пользуются чаще “симптомом щипка” (на месте щипка через несколько минут появляется кровоизлияние, которое увеличивается неадекватно нанесенной травме капилляров) или “симптомом жгута” (симптом считается положительным, если при наложении на плечо жгута или манжетки тонометра на 3 мин при давлении 50 мм рт. ст. возникают петехии в количестве не менее одной на 1 см2).
В последние годы при диагностике тромбоцитопатий (качественных изменений тромбоцитов) стали применять методы, позволяющие изучить адгезию, агрегацию, реакцию освобождения тромбоцитов.
Из способов изучения адгезии тромбоцитов наиболее информативными являются закрытые методы, при которых кровь прямо из вены пропускается через колонку со стеклянными бусами (диаметр 0,5 мм) с соблюдением времени контакта. По разнице количества тромбоцитов в крови до и после прохождения через колонку судят о количестве тромбоцитов, подвергшихся адгезии к стеклу.
Агрегацию тромбоцитов исследуют в обогащенной тромбоцитами плазме крови с помощью ФЭКа или специальных фотометров (агрегометров), либо микроскопически – путем подсчета тромбоцитарных агрегатов и свободно лежащих тромбоцитов.
Агрегационную функцию тромбоцитов определяют при воздействии различных физиологических агрегирующих агентов: оптимальных и малых доз АДФ, коллагена (в эмульсии), адреналина, малых доз тромбина.
При использовании малых доз АДФ и адреналина выявляется вторая волна агрегации, обусловленная “реакцией освобождения” из тромбоцитов собственных агрегирующих агентов (АДФ, адреналина, тромбоксана и др.). Отсутствие второй волны агрегации – важный признак некоторых тромбоцитопатий. Дополнительное представление о реакции освобождения дает изучение тромбоцитарных факторов в плазме крови – 4-го пластиночного фактора, серотонина и др.
Исследование тромбоцитарных компонентов после разрушения тромбоцитов (ультразвуком или повторными замораживанием и оттаиванием) способствует разграничению нарушений реакции освобождения от недостаточности пула накопления в клетках этих компонентов. Исследование агрегации тромбоцитов под влиянием ряда нефизиологических агентов, например ристоцетина и бычьего фибриногена, используют в основном при диагностике болезни Виллебранда и синдрома Бернара–Сулье.
Кроме этих методов применяют электронно-микроскопические (изучение ультраструктуры тромбоцитов), радиоизотопные (определение продолжительности жизни тромбоцитов), гистологические (исследование мегакариоцитов в срезах костного мозга) и иммунологические (определение антитромбоцитарных антител).
Date: 2015-07-02; view: 1439; Нарушение авторских прав