
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ультразвуковая допплерография
|
|
Метод ультразвуковой допплерографии (УЗД) основывается на том, что направленная на сосуд ультразвуковая волна отражается от клеточных элементов крови (преимущественно эритроцитов). В зависимости от скорости и направления движения последних длина ультразвуковой волны изменяется, что регистрируется прибором в виде сонограммы. Математическая обработка сигнала позволяет определить направление кровотока, максимальную (МСК) и среднюю (ССК) скорость кровотока и индекс пульсации (ИП).
В неврологических и нейрохирургических клиниках широко используют УЗД магистральных сосудов, а также транскраниальную допплерографию. Первую проводят с помощью датчика с частотой излучения 5-8 мГц в постоянном режиме работы. Исследуя сонные артерии, датчик направляют вдоль сосуда по передней поверхности грудино-ключично-сосцевидной мышцы в направлении головы. На уровне щитовидного хряща общая сонная артерия (ОСА) образует бифуркацию и разделяется на внутреннюю сонную (ВСА) и наружную сонную (НСА) артерии, которые исследуют на уровне угла нижней челюсти, учитывая, что НСА расположена медиально, а ВСА ла-терально. Характер кровотока в НСА и ОСА имеет периферический тип; во время диастолы кровоток в них значительно снижается, что обусловливает повышение индекса пульсации до 2-2,5. Кровоток в ВСА во время диастолы остается довольно значительным.
Позвоночные артерии (ПА) в экстракраниальном отделе исследуют под сосковидным отростком, направляя датчик в сторону головы. Более глубокое расположение
ПА усложняет поиск, сонограмма в сравнении с таковой сосудов каротидно-го бассейна имеет меньшую амплитуду, достаточно часто во время диастолы кровоток не регистрируется.
Нарушение нормальной формы сонограммы и (или) направления кровотока позволяет обнаружить морфологические изменения сосудов. Метод УЗД не позволяет визуализировать сосудистую сетку и непосредственно место стеноза, поэтому скорость кровотока чаще измеряется в участке после стеноза. Умеренный стеноз (на 50-75 % просвета сосуда) сонной артерии сопровождается снижением скорости кровотока, а в случае значительного стеноза (больше чем 75 %) исчезает кровоток во время диастолы. При наличии стеноза ПА может регистрироваться снижение скорости кровотока и во время систолы. Двунаправленный кровоток свидетельствует об извитости сосуда. Следует отметить, что изменения показателей МСК и ССК могут возникать на фоне нарушений общей гемодинамики (аритмия, снижение сердечного выброса). Точность диагностики стенозирующих поражений методом УЗД во многом зависит от возможностей аппаратуры и опыта исследователя. Важным дополнительным диагностическим критерием может быть асимметрия скорости кровотока в симметричных сосудах.
Современная диагностическая аппаратура дает возможность исследовать сосуды более чувствительным методом ультразвукового исследования - методом дуплексного допплеровского сканирования (ДДС). С помощью этого метода можно получить изображение стенки сосуда, провести ее идентификацию и поместить допплеровский объем в нужный участок сосуда. Полученное изображение сосуда дает важную информацию о расположении и ходе сонных и позвоночных артерий, происхождении патологических изменений, типе и размерах бляшки, степени стеноза, который чаще измеряют по уменьшению диаметра, реже - по площади сосудистого просвета (уменьшение диаметра на 50 % отвечает уменьшению площади на 70 %).
По строению бляшки разделяют на четыре категории: 1) гипоэхогенные, с тонким ободком на поверхности; 2) преимущественно гипоэхогенные, но с небольшим эхогенным содержимым внутри; 3) преимущественно эхоген-ные, но с небольшими гипоэхогенными участками; 4) полностью эхогенные. Доказано, что первые две категории чаще сопровождаются транзиторными ишемическими атаками, поскольку гипо-эхогенный тип отвечает хрупкому, ломкому виду бляшек. В отдельных случаях изъязвление бляшки визуализируется как дефект поверхности.
Цветное допплеровское исследование дает информацию о направлении, скорости, турбулентности кровотока, позволяет отличить стеноз высокой степени (> 90 %) от окклюзии. Наличие цветного сигнала свидетельствует о сохранении кровотока и указывает его направление: красный к датчику, синий - от датчика. Следует отметить, что в случае значительных стенозов скорость кровотока снижается. В таких случаях цветное допплеровское исследование регистрирует колебание тканей как зону густо размещенных хаотических цветных вспышек.
В клинической практике важным является разделение всех больных на четыре группы: 1) лица, у которых артерии нормальные; 2) лица с легкой и гемодинамической несущественной патологией артерий, т. е. диаметр артерий сужен меньше чем на 50 %, а бляшки эхогенные; 3) лица со значительной патологией артерий, т. е. их диаметр сужен больше чем на 50 %; 4) лица с клинической и гемодинамической значительной патологией артерий, т. е, диаметр их сужен больше чем на 70 % или видно язву на бляшке. Больным четвертой группы целесообразно проводить операцию каротидэндартерэк-томии из-за высокого риска возникновения инсульта. Наибольшее диагностическое значение имеет соотношение МСК во внутренних и общих сонных артериях (систолическое соотношение ВСА/ОСА; табл. 3). Доказано, что дуплексный допплеровский метод имеет общую чувствительность 96 %, специфичность - 86 % и точность - 91 % для выявления сужений диаметра свыше 50 %.
Исследование интракраниальных сосудов методом транскраниальной допплерографии (ТКД) проводится с помощью датчика с частотой 2 мГц в пульсовом режиме работы, что дает возможность задавать нужную глубину исследования для каждого сосуда. Ультразвуковой поиск проводят через «ультразвуковые окна»: темпоральное, орбитальное, окципитальное, что изображены на рисунке.
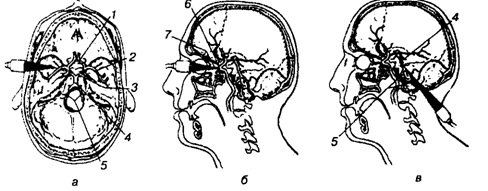
«Ультразвуковые окна» для инсонации сосудов артериального круга большого мозга:
а - височное; б - глазное; в - затылочное; 1 - передняя мозговая артерия; 2 - средняя мозговая артерия; 3 - задняя мозговая артерия; 4 - основная артерия; 5 - позвоночные артерии; 6 - сифон внутренней сонной артерии; 7 - глазная артерия
Через темпоральное окно, которое находится между внешним краем глазницы и ушной раковиной выше уровня скуловой кости, на глубине 50-55 мм регистрируют среднюю мозговую артерию (СМА), в норме ее кровоток направлен к датчику. На глубине 60-65 мм находится бифуркация интракраниального отдела внутренней сонной артерии (иВСА), кровоток в ней двунаправленный. Несколько кпереди на глубине 70-75 мм лежит передняя мозговая артерия (ПМА), кровоток в которой направлен от датчика. Позади и книзу на глубине 65-70 мм расположена задняя мозговая артерия (ЗМА), кровоток в которой направлен к датчику.
Через орбитальное окно на глубине 45-50 мм инсонируют глазную артерию (ГА), кровоток в ней направлен к датчику; а на глубине 55-65 мм определяют сифон и ВСА, где кровоток чаще двунаправленный.
Окципитальное окно расположено между краем затылочного отверстия и атлантом. Поиск ПА проводят на глубине 65-70 мм, отклоняя датчик латерально от средней линии. На глубине 80-100 мм находится основная артерия (OA). В этих сосудах кровоток в норме направлен от датчика.
Характер кровотока в интракраниальных сосудах существенно отличается от кровотока в экстракраниальных артериях. В отличие от последних, кровоток в интракраниальных артериях имеет постоянный характер, не прекращается даже во время диастолы. Скорость диастолического кровотока значительная и составляет около половины систолической, индекс пульсации - 0,8-1,2 (рис. 86).
Изменение скорости кровотока и его направления дает возможность обнаружить как морфологические, так и функциональные, изменения интракраниальных сосудов. С помощью ТКД можно обнаружить стеноз или окклюзию мозговых сосудов, признаки коллатерального кровотока в пределах артериального (виллизиевого) круга большого мозга, степень его компенсаторных возможностей, вазоспастические и вазопаретические изменения сосудистой системы мозга.
По данным ТКД, незначительный стеноз внутричерепных сосудов увеличивает МСК. Умеренный стеноз еще в большей степени повышает систолическую и диастолическую скорость, появляются признаки турбулентного кровотока, ИП снижается до 0,5-0,6. Когда стеноз превышает 75 %, достаточно часто наблюдается уменьшение скорости кровотока дистальнее места стеноза.
Интракраниальный стеноз сопровождается появлением коллатерального кровотока, который возникает в сосудах артериального круга мозга. Чаще всего наблюдается стеноз иВСА в области сифона. В таких случаях возникает компенсаторное перераспределение крови из противоположного полушария большого мозга через переднюю соединительную и переднюю мозговую артерии. Направление кровотока в последней изменяется. Наблюдается компенсаторный кровоток из НСА через ГА на стороне стеноза, который также сопровождается изменением направления кровотока. Иногда увеличивается скорость кровотока в ПА и OA. Часто стеноз возникает одновременно в нескольких сосудах. Диагностика таких случаев является достаточно сложной и требует опыта.
Острые и хронические нарушения мозгового кровообращения сопровождаются различными по характеру расстройствами, которые определяются во время ТКД. У больных с преходящими нарушениями мозгового кровообращения чаще наблюдается локальное снижение, реже - повышение скорости кровотока. Около 33 % больных имеют признаки стенозирующе-го интракраниального поражения. У больных с ишемическим инсультом возникают распространенные гемодинамические изменения. Наблюдается снижение или повышение скорости кровотока не только в пораженном бассейне, но и в других сосудах артериального круга мозга. Почти у 50 % больных обнаруживают признаки стеноза интракраниальных артерий. Повторное обследование таких больных свидетельствует, что у подавляющего большинства из них в течение 10-14 сут происходит реканализация просвета сосудов с нормализацией скорости кровотока.
Ввиду того, что метод ТКД является неинвазивным и высокоинформативным, его использование у больных в острый период заболевания дает возможность проследить за динамикой изменений кровотока, уточнить характер сосудистого процесса, оценить эффективность лечебных мероприятий, а также реактивность церебральных сосудов.
Субарахноидальное кровоизлияние сопровождается в начале заболевания спазмом сосудов, который связывают с токсическим действием на их стенку продуктов распада гемоглобина. МСК повышается во всех сосудах артериального круга мозга. В частности, в СМА она возрастает до 200— 250 см/с и имеет высокую обратную корреляцию с диаметром сосуда по ангиографическим признакам. Ранняя диагностика спазма позволяет проводить адекватные профилактические и лечебные мероприятия, предотвращать высокий риск осложнений.
У большинства больных с дисциркуляторной энцефалопатией отмечается снижение скорости кровотока в церебральных сосудах, что свидетельствует о медленно прогрессирующем дефиците мозгового кровообращения. У пациентов с остеохондрозом шейного отдела позвоночника, который сопровождается спондилоартрозом, формированием задних и заднебоковых унковертебральных остеофитов, часто возникает экстравазальная компрессия ПА и симпатических позвоночных сплетений. ТКД обнаруживает снижение скорости кровотока в ПА и OA, а в тяжелых случаях признаки коллатерального кровотока из каротидной системы через артериальный круг мозга в OA, на что указывает обратный или двунаправленный кровоток в ней. Метод является высокоинформативным для выявления интракрани-альной эмболии артериоартериального происхождения. Его применяют для мониторинга во время нейрохирургических операций. Использование ТКД в отделениях реанимации позволяет обнаруживать повышение внутричерепного давления, диагностировать смерть мозга.
Одним из самых современных методов ультразвукового исследования интракраниальных сосудов является транскраниальное дуплексное сканирование (ТДС) с цветным допплеровским картированием кровотока. Исследование проводят секторным датчиком с частотой 2 мГц, используя три стандартных доступа: транстемпоральный, трансорбитальный и трансок-ципитальный. Сначала в В-режиме получают изображение структур мозга на уровне артериального круга мозга, в режиме цветного допплеровского картирования кровоток окрашивается в красный (к датчику) или синий (от датчика) цвет. Полученное изображение сосудов артериального круга мозга дает возможность проводить коррекцию угла между ультразвуковым лучом допплеровского объема и направлением течения крови в артерии, что делает исследование скорости кровотока наиболее точным. ТДС позволяет измерять диаметр сосудов, МСК (систолическую) и ССК, а также рассчитать объемный мозговой кровоток. Трудности в определении диаметра интракраниальных сосудов не дают возможность широко использовать показатель объемного кровотока в клинической практике. Стенозирующие изменения сосудов артериального круга большого мозга сопровождаются повышением скорости кровотока в них. R.W. Baumgartner и соавторы (1999) предлагают критерии определения степени стенозирования интракраниальных сосудов (табл. 4).
Методы визуализации мозговых структур
К новым рентгенорадиологическим методам, которые дают высококачественную информацию относительно структурно функционального состояния мозга в норме и при патологии, принадлежат компьютерная томография, магнитно-резонансные томография и спектроскопия, позитронная эмиссионная томография, диффузионно-взвешенная и перфузионно-взвешенная магнитно-резонансная томография.
Компьютерная томография (КТ) мозга основывается на принципе образования изображения органов и тканей с помощью ЭВМ. Метод заключается в том, что после прохождения лучей сквозь тело пациента они попадают не на экран, как в случае использования обычной рентгеновской аппаратуры, а на чувствительные детекторы, в которых возникают электронные импульсы. После усиления они передаются на ЭВМ, реконструируются и создают изображение объекта. Изображения органов и тканей при КТ получают на мониторе в виде поперечных срезов толщиной от 8 до 2 мм.
КТ имеет ряд преимуществ перед обычным рентгенологическим исследованием: позволяет дифференцировать отдельные органы и ткани, которые отличаются по плотности в пределах 1-2 %, а на томограммах 4-го поколения - до 0,5 % (на обычных рентгенограммах этот показатель составляет 10-20 %); обеспечивает четкое изображение органов и патологических очагов без наложения выше и ниже расположенных образований благодаря исследованию только в плоскости отдельного среза; дает точную количественную информацию о размерах, плотности отдельных органов и тканей или патологических образований; позволяет оценить не только состояние исследуемого органа, но и взаимоотношения патологического очага с прилегающими органами и тканями.
Диагностика с помощью КТ основывается на прямых рентгенологических симптомах, т. е. определении точной локализации, формы, размеров отдельных органов и патологического образования по показателям плотности или абсорбции (показатель абсорбции - степень поглощения или ослабления пучка рентгеновского излучения во время прохождения сквозь тело человека).
КТ дает возможность выявить патологические очаги диаметром 0,5-1 см. Для повышения диагностических возможностей проводится усиление изображения с помощью внутривенного введения рентгеноконтрастных веществ. В результате этого усиливается денситометрическое отличие между нормальной и патологически измененной тканью (из-за разного кровенаполнения). Контрастирование имеет значение для дифференциальной диагностики доброкачественных и злокачественных новообразований, для оценки характера и степени нарушения функции отдельных органов и систем.
КТ является одним из наиболее информативных методов диагностики сосудистых заболеваний мозга. В частности, верифицируются ишемические и геморрагические поражения мозга, достоверность диагностики которых в первые дни составляет соответственно 74 % и 98,7 %. Метод позволяет четко отличать геморрагию (участок повышенной плотности белого цвета; рис. 88) от инфаркта мозга (участки сниженной плотности темного цвета; рис. 89). Очаг кровоизлияния обнаруживают в первые часы после его возникновения, инфаркт - не раньше чем через 6-8 ч, чаще - в конце 1-х суток. Инфаркт полушария большого мозга определяется лучше, чем стволовой, и дифференцируется в конце 1-х суток. С помощью КТ возможна прижизненная диагностика отдельных лакунарных инфарктов, которые выявляются как небольшие очаги сниженной плотности в глубоких структурах головного мозга. Обнаружены прямые и вспомогательные признаки дисциркуляторной энцефалопатии различного генеза. Значительную роль играет КТ в диагностике церебральной аневризмы и субарахноидального кровоизлияния; достаточно четко верифицируется внутримозговая гематома. В случае ушиба головного мозга наблюдается сочетание участков сниженной плотности (зона некроза и отека тканей) и повышенной (зона геморрагии) плотности с реакцией ткани.
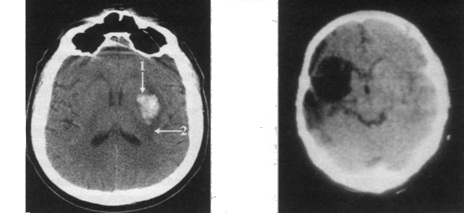
| КТ головного мозга больного с инсульт-гематомой левой височно-подкорковой области в первый день после инсульта: 1 - внутримозговая гематома; 2 - перифо-кальный отек ткани мозга | КТ головного мозга больного через 18 ч от начала инсульта: очаг пониженной плотности неправильной формы в правой лобно-височно-теменной области подтверждает наличие инфаркта головного мозга |
КТ позволяет достоверно диагностировать опухоль головного мозга и нередко определить правильный гистологический диагноз.
Для злокачественной опухоли характерны такие признаки: неравномерность плотности образования (чередование зон повышенной и сниженной плотности в середине опухоли); наличие зоны некроза, участков сниженной и повышенной плотности неправильной формы, обусловленных кровоизлиянием; местный и перифокальный отек белого вещества.
КТ-изображение абсцесса характеризуется кольцевидным повышением плотности. Такое кольцевидное образование (корона-эффект) может наблюдаться и в случае злокачественной опухоли, однако только при абсцессах отмечается слоистость. Существенную роль КТ играет в диагностике воспалительных заболеваний головного мозга, гидроцефалии.
КТ используют для проведения математических расчетов во время выполнения стереотаксических операций. Неинвазивность этого метода обеспечивает несомненные преимущества его над инвазивными методами исследования (ангиография, пневмоэнцефалография).
Магнитно-резонансная томография (МРТ). В настоящее время с КТ успешно конкурирует метод, который основывается на феномене ядерно-магнитного резонанса (ЯМР). Доказано, что некоторые ядерные частицы, которые находятся в магнитном поле, под действием импульса радиоволн определенной частоты выпускают долю поглощенной энергии в виде радиосигнала. Эффект ЯМР был открыт американскими исследователями F. Bloch и Е. Purcell (1946). Изображение головного мозга впервые было получено Y. Holland в 1980 г.
Для проведения МРТ человека помещают в специально созданное магнитное поле. Под его влиянием в объекте будут резонансными только те зоны, напряжение магнитного поля которых будет точно совпадать с требованиями резонанса. Если изменять местоположение участка резонанса (продвигая его по объекту), можно просканировать весь организм человека. При таком условии карта распределения вещества, выведенная на дисплей, образует MP-томограмму. Другой путь - облучение объекта импульсом, который содержит определенный спектр частот. В таком случае каждая частота будет соответствовать своему резонансному напряжению и станет возможным сразу получить информацию из большого объема тканей. Наиболее информативна для врача карта распределения протонов или воды в теле человека. С одной стороны, распределение протонов наиболее важное, поскольку тело человека (в частности, мозговое вещество) состоит на 70 - 80 % из воды, с другой - большое количество протонов имеет высокий уровень сигнала и облегчает работу.
Ценность метода МРТ заключается в том, что физиологичные движения в организме человека (дыхание, сердечная деятельность, перистальтика кишок) существенно не влияют на изображение. Кроме того, не нужна специальная подготовка пациента к обследованию. Отсутствие видимых артефактов, обусловленных костными структурами и полостями, которые содержат газ, свидетельствует о преимуществе МРТ при исследовании задней черепной ямки, брюшной полости и области таза.
МРТ-аппаратура относительно простая с точки зрения технологии, несложная в обслуживании, может использоваться ежедневно. У пациентов, которые неоднократно находились под воздействием сильных магнитных полей радиочастотных импульсов, не выявлено увеличения частоты заболеваемости. Преимуществом МРТ перед КТ являются более значительная информативность и высокое контрастирование.
Недостатком метода является то, что очаги обызвествления в тканях до определенных размеров не получают отображения. Применение МРТ в клинической практике ограничено из-за высокой стоимости аппаратуры и необходимости специального помещения.
Период, необходимый для получения изображения на современных аппаратах, колеблется в пределах 130 мин (в среднем 24 мин на срез в зависимости от режима исследования). Пространственная разрешающая способность метода достигает 0,2 см на изображениях глаза, позвоночника и др. Для сравнения рентгеновский компьютерный томограф фирмы «Сименс» дает пространственное разрешение 0,1 см.
Метод МРТ в последнее время все шире применяется в неврологии. Это объясняется возможностью получения трехмерного объекта без изменения его положения и передвижения сканирующего прибора. Таким образом, в отличие от КТ можно получить изображение срезов в разных плоскостях (фронтальной и сагиттальной). Это важно для диагностики патологических процессов в головном мозге, на основании черепа, в задней черепной ямке, в участке краниовертебрального перехода. С помощью МРТ получают контрастное изображение белого и серого мозгового вещества, а также ликворных пространств мозга в соответствии с градацией оттенков так называемой серой шкалы: жировая ткань на томограмме белая, потом, с нарастанием интенсивности цвета, головной мозг, спинной мозг, паренхиматозные органы, сосудистые стенки и мышцы. Воздух, кости, очаги обызвествления, практически не дают MP-сигналов и выглядят черными. На MP-томограмме хорошо проявляются такие патологические процессы, как опухоль, киста, абсцесс, ишемические и геморрагические очаги (рис. 90). Признаки ишемии мозговой ткани на МР-томограмме обнаруживают через 6-7 ч еще до визуализации на КТ. В пределах инфаркта мозга, который развивается, можно четко увидеть гетерогенные зоны. В отличие от КТ, МРТ дает возможность диагностировать патологические процессы в стволе головного мозга и мозжечке.
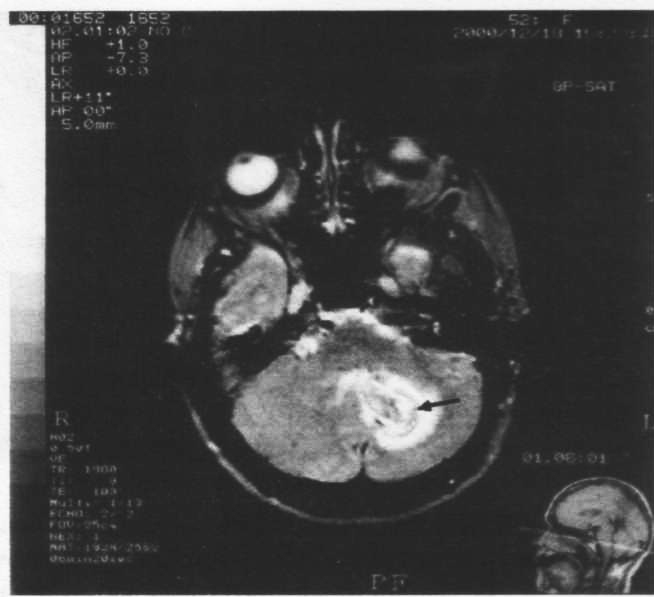
MPT головного мозга на 3-й день от начала инсульта (Т2-взвешенное изображение, аксиальная плоскость):
в левом полушарии мозжечка визуализируется участок гетерогенной интенсивности (показано стрелкой), обусловлен развитием геморрагического инфаркта с компрессией IV желудочка мозга и перифокальным отеком
Наблюдаются некоторые особенности МРТ опухолей головного мозга. Значительную интенсивность изображения дает глиома (это объясняется большим содержанием мобильных протонов в опухоли). МРТ позволяет установить распространение опухоли вдоль медиальной поверхности полушарий с проникновением ее в боковые желудочки мозга. В сравнении с КТ мозга на МРТ более четко констатируется непроникновение опухоли в полость черепа, однако менее заметны костные спикулы. Доброкачественные опухоли - мснингиома, невринома VIII пары черепных нервов - в большинстве случаев характеризуются непродолжительностью релаксации в отличие от злокачественных опухолей. Более ин<}юрмативно в сравнении с КТ определение опухоли в участке турецкого седла, задней черепной ямки. Эффективным также является применение КТ и МРТ в диагностике субдуральной гематомы. С помощью МРТ четко определяются пределы кровоизлияния, центральная его часть; можно увидеть участок отека вокруг кровоизлияния.
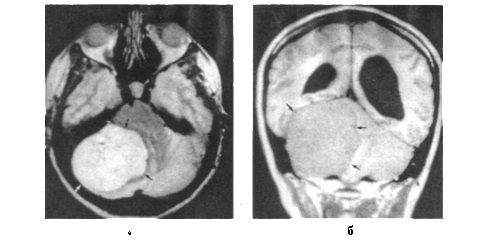
МРТ головного мозга (Т2-взвешенное изображение, аксиальная плоскость) с контрастированием (а, б):
визуализируется менингиома больших размеров (показано стрелками) в задней черепной ямке
Эффективное применение МРТ для диагностики дегенеративных, воспалительных процессов головного мозга, энцефалопатии, демиелинизи-рующих заболеваний. С помощью МРТ хорошо верифицируются очаги домиелинизании в структурах задней черепной ямки, определяются склеротические бляшки при рассеянном склерозе. Информативным является использование МРТ для диагностики сирингомиелии, компрессии спинного мозга.
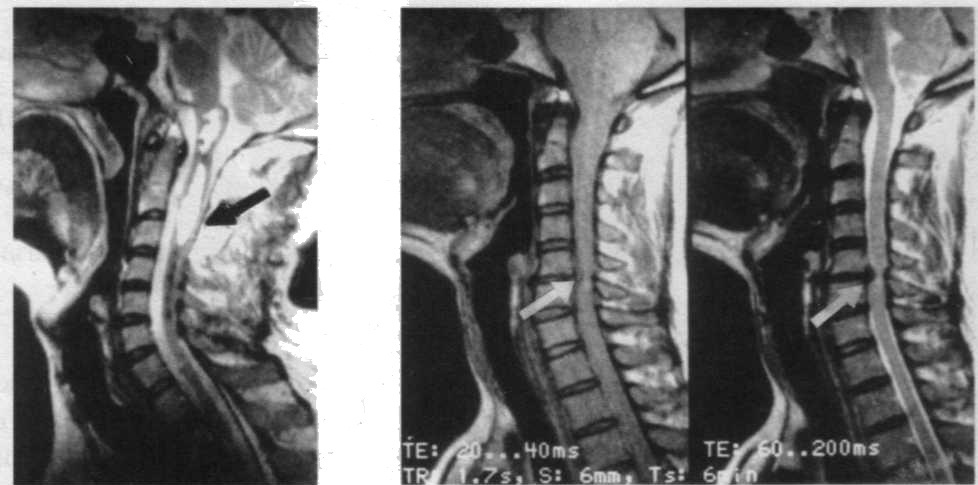
| На сагиттальной МРТ визуализируется сирингомиелитическая полость, содержащая спинномозговую жидкость | МРТ при грыже диска: визуализируется истончение и компрессия спинного мозга на уровне CVI позвонка |
Большое значение имеет МРТ в прижизненной диагностике лакунарных инфарктов в глубоких отделах полушарий большого мозга, в области моста; при такой локализации очаги поражения определяются приблизительно в 90 % случаев. С помощью МРТ можно в 2,5 раза чаще, чем на КТ, визуализировать очаговые поражения мозга при наличии тран-зиторных ишемических атак. Важным преимуществом МРТ является возможность определять поражение даже мелких артерий головного мозга (аа. lenticulostriata, chorioidea и др.).
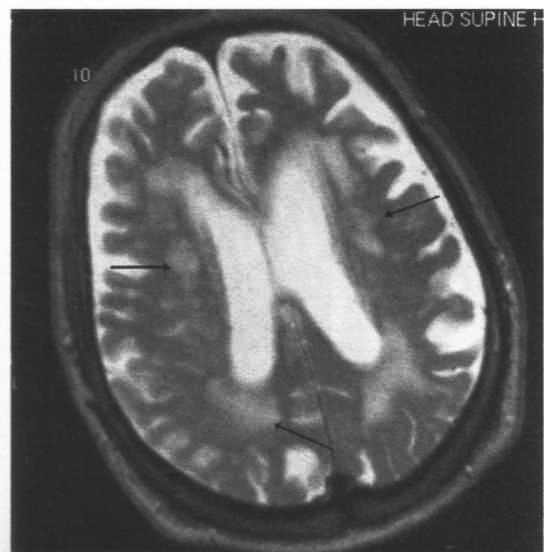
МРТ головного мозга через 10 ч от начала заболевания (аксиальная плоскость, срезы на уровне тел боковых желудочков):
на Т2-взвешенном изображении выявлены множественные очаги перенесенных лакунарных инфарктов с обеих сторон (показано стрелками)
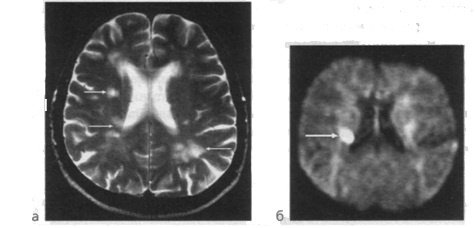
МРТ головного мозга через 46 ч от начала развития лакунарного инфаркта (аксиальная плоскость, срезы на уровне тел боковых желудочков):
а - в Т2-взвешенном изображении на фоне множественных гиперинтенсивных очагов (показано стрелками) свежий ишемический очаг выделить тяжело; б - ДВ МРТ - определяется свежий ишемический очаг лакунарного инфаркта в задних отделах тела хвостатого ядра и прилегающей задней ножки внутренней капсулы справа (показано стрелками) со сниженным коэффициентом диффузии
Диффузионно-взвешенная (ДВ) МРТ была впервые описана Carг и Purcell в 1954 г. В 1975 г. P. Mansfield развил эхо-планарные изображения, которые стали основанием для внедрения ДВ изображений в клиническую практику. Методика ДВ МРТ основывается на случайном движении водных молекул, которое обусловливает контрастное изображение. Молекулы внутриклеточной воды в тканях двигаются беспорядочно, сталкиваясь одна с другой, и проходят через клеточные мембраны. Такой тип движения молекул известен как диффузия. Диффузия характеризуется коэффициентом диффузии (D) - средним квадратом расстояния, которое проходят молекулы за единицу времени. На практике коэффициент диффузии точнее определяется как измерительный коэффициент диффузии - ИКД (apparent diffusion coefficient - ADC).
Исследование на животных и клинический опыт показали, что MP* томограммы с возможностью получения ДВ-изображения это самая современная техника для выявления ишемии головного мозга человека в течение первых часов после ее возникновения и до патологического изменения сигнала на Т2-взвешенных изображениях. Острая ишемия головного мозга обусловливает снижение диффузии жидкости в ишемизи-рованной ткани головного мозга. Ограничение диффузии воды возникает в результате недостаточности энергии, связанной с потерей тканевой АТФ, снижением активности Na+/K+-ATO-азы, ослаблением функции натрий-калиевой помпы и возникновением цитотоксического отека ишемизирован-ной ткани мозга. В дальнейшем это приводит к аккумуляции внутриклеточной воды и уменьшению ее объема во внеклеточном пространстве. Ткань, в которой диффузия воды снижается, может быть быстро обнаружена (как гиперинтенсивная зона) на ДВ MP-изображении. Эти изменения сигнала отображают снижение ИКД воды в ишемизированной ткани головного мозга.
Таким образом, визуализация инфарктного ядра на эхо-планарном ДВ MP-изображении основывается на избыточном накоплении ишемизированной тканью мозга внутриклеточной воды (из-за ограничения диффузии), которая проявляется гиперинтенсивным MP-сигналом на ДВ-изображении и гипоинтенсивным сигналом ИКД на картах (из-за снижения коэффициента диффузии). ИКД диффузии отображает тонкие структурные и функциональные изменения в головном мозге. Высокий MP-сигнал на ДВ МР-изображении появляется раньше изменений, которые наблюдаются при использовании КТ и МРТ в Т2-взвешенном изображении. Снижение ИКД позволяет различить множественные инфаркты, определить новые очаги прогрессирующего инфаркта мозга.
Вторая современная чувствительная методика не про визуализации головного мозга - перфузионно-взвешенная (ПВ) МРТ, которая дает ин-
формацию о гемодинамическом состоянии ткани мозга и может обнаружить нарушение перфузии в участке инфарктного ядра и в окружающих коллатеральных участках. Поэтому в течение первых 1-6 ч после развития инсульта расстройства перфузии на ПВ-изображении, как правило, шире, чем на ДВ-изображении.
ПВ-изображения (ПВ МРТ или КТ) позволяют обнаруживать гипо-перфузионные участки головного мозга при наблюдении транзита быстро введенного контрастного вещества или магнитного маркера водных молекул через артериальную кровь головного мозга. В участках, расположенных дистальнее артериальной окклюзии, поступление контрастного вещества или маркирующих водных молекул может быть замедленным. Результирующая кривая «сигнал-время» может превратиться в кривую «концентрация-время», по которой можно определить функции, которые отображают региональную перфузию. Для получения ПВ MP-изображения используют разные контрастные вещества, которые содержат хелаты гадолиния. В частности, чаще всего применяют гадолиний, учитывая эффект восприимчивости, возникающий в прилегающих тканях и снижающий время Т2-взвешенного изображения, которое определяется низким сигналом при соответствующих последовательностях. Итоговое изменение сигнала зависит от нескольких факторов, которые включают количество контраста гадолиния в области предполагаемого очага поражения.
В клинической практике чаще используют только ДВ-изображение, значительно реже - комбинацию ДВ- и ПВ-изображения, еще реже - только ПВ-изображение. ПВ- и ДВ-изображения отображают ишемические изменения в первые 1-6 ч после развития ишемического инсульта, т. е. до появления структурно-морфологических изменений ткани мозга. Допускают, что ПВ- и ДВ МРТ являются эффективными методами для прогнозирования клинических последствий острого инфаркта, а диффузионно-перфузионные несоответствия ДЗ/ПЗ отображают размеры жизнеспособной ткани ише-м и ческой полутени, т. е. ткани с риском развития инфаркта.
Следовательно, так называемое диффузионно-перфузионное несоответствие определяется как разница между значительными изменениями на картах ПВ МРТ и меньшими изменениями на ДВ МРТ. ДВ МРТ в сочетании с ПВ МРТ достаточно информативна для ранней детекции пораженного участка мозга и ишемической полутени (пенумбры), она имеет важное значение в решении вопроса целесообразности проведения тромболизиса после острого ишемического инсульта.
Магнитно-резонансная спектроскопия (МРС) основывается на тех же физических принципах, что и МРТ. Однако, если для получения МР-томограммы нужно изменение гомогенности внешнего магнитного поля, то для МРС необходимо именно гомогенное магнитное поле в участке исследования. Радиоволны, которые высвобождаются ядрами разных химических элементов, превращаются в спектры, которые отображают концентрацию этих элементов. Метод МРС высокоинформативный, основан на измерении спектров разных химических элементов.
С помощью МРС возможно проведение дистантного нейрохимического анализа метаболических изменений денервированной ткани в норме и при различных патологических состояниях на субмолекулярном уровне. Этот метод позволяет определить внутриклеточный рН мозга, концентрацию аминокислот, липидов, гликогена и других метаболитов.
Среди всех методов группы Neuroimaging МРС дает возможность в наиболее ранние сроки диагностировать ишемию мозга, признаки которой появляются уже через 30 мин после развития. Информативный этот метод также для ранней диагностики отека головного мозга ишемической природы. Обнаружено, что в зоне ишемии и соответствующем участке противоположного полушария мозга внутриклеточный рН смещается в сторону алкалоза, что расценивают как неблагоприятное условие для восстановления неврологических функций. Существенные изменения метаболизма высокоэнергетических фосфатов обнаружены с помощью МРС и при мультиинфарктной деменции.
Перспективным является применение МРС в нейроонкологии. Во время обследования методом 31Р-МРС выявляется смещение рН в щелочную сторону с ростом степени малигнизации. Этот метод можно использовать также для оценки эффективности лечения опухолей головного мозга, выбора самого адекватного терапевтического режима.
Большое значение имеет применение МРС в детской неврологии. Метод дает возможность обнаружить метаболические нарушения, характерные для церебральной гипоксии, и успешно осуществить их коррекцию. С помощью МРС можно получить значимую информацию также при церебральной атрофии и менингите. Эффективным является использование МРС с прогностической целью: во время асфиксии в родах сначала повышена концентрация неорганического фосфата и снижен уровень фосфорилкреатина. При улучшении клинической картины эти показатели нормализуются. Метод позволяет объективизировать смерть мозга на основании отсутствия в ткани АТФ или фосфорилкреатина.
Перспективным является применение метода МРС в диагностике некоторых нервно-мышечных заболеваний, а также для наблюдения за метаболическими сдвигами в мышцах под воздействием лечения. Считают, что наиболее ранняя диагностика врожденных дефектов метаболизма нервной ткани станет возможной в случае распространения 31Р-МРС.
Широкое использование МРС в нейрофармакологии позволит изучать концентрации меченых фармакологических препаратов в сосудистом русле различных органов, в том числе в мозге. С помощью 23Na- и 39К-МРС принципиально возможны исследования процессов на клеточно-мембранном уровне, в частности изменений калий-натриевых взаимоотношений внутри клетки и снаружи.
В связи с отсутствием ионизирующего излучения методика МРС безвредна. Потенциальные диагностические возможности ее в различных отраслях медицины, в том числе и неврологии, очень большие. Последующее усовершенствование техники МРС будет способствовать повышению чувствительности и специфичности метода, позволит изучать церебральный метаболизм, основываясь на спектральном анализе самых разнообразных химических элементов.
Позитронная эмиссионная томография (ПЭТ) один из методов, которые совмещают возможности КТ и радиоизотопной диагностики для исследования регионарного метаболизма и кровообращения головного мозга. Принцип метода заключается во введении в организм человека (с едой, воздухом, внутривенно) фармакологических препаратов, содержащих малое количество изотопа, который недолго существует. После распространения соединения внутри организма снимается карта распределения изотопа позитронно-эмиссионная томограмма. Физический метод ПЭТ заключается в следующем: изотоп выпускает позитроны, каждый из которых после пробега нескольких миллиметров взаимодействует с электроном, излучая два гамма-кванта, которые разделяются под углом 180°. Специальные детекторы регистрируют время появления гамма-квантов. С помощью полученных данных рассчитывается местоположение источника излучения, которое выводится на дисплей обычным для КТ способом.
Пространственный спектр ПЭТ меньше, чем рентгеновская или МР-томография (составляет несколько миллиметров), однако способность регистрировать отдельные пары гамма-квантов обеспечивает очень высокую его чувствительность. Прибор способен регистрировать минимальные изменения концентрации изотопа, а следовательно и наименьшие изменения связанного с ним фармакологического агента. В этом заключается диагностическая ценность метода. ПЭТ основывается на использовании недолго-существующих изотопов (11С, 13N, 150, 18Р и т. п.), которые входят в состав метаболитов мозга (глюкозы, аминокислот, нейротрансмиттеров).
Метод неинвазивный, отсутствие остаточного ионизирующего излучения делает его безопасным для больных и поэтому позволяет наблюдать за ними в динамике. Однако ПЭТ нуждается в выполнении определенных технических требований: источник, который генерирует изотопы, должен находиться вблизи томографа.
Одним из важных направлений использования ПЭТ является изучение сосудистой патологии головного мозга. Нарушение перфузии мозга с помощью ПЭТ определяется сразу после развития ишемии, которая значительно опережает возможности МРТ и КТ-верификации. Применяя ПЭТ, можно исследовать не только мозговой кровоток, но и церебральный метаболизм, что позволяет своевременно проводить коррекцию этих нарушений. В частности, ПЭТ дает информацию об изменениях регионарного мозгового кровотока, общего объемного кровотока, скорости метаболизма по кислороду и глюкозе. Изучение этих показателей дает возможность обнаружить отличия между зоной инфарктного ядра и ишемической полутенью (где нейроны еще жизнеспособны), а также участками мозга с нормальными показателями метаболизма и кровотока. Благодаря ПЭТ определены параметры мозгового кровотока, в пределах которых сохраняется жизнеспособность нейронов, а также проведена сравнительная характеристика компенсированной (гипоксической) и необратимой (ишемической) гипоперфузии ткани мозга. По данным ПЭТ, ишемический инсульт в 75 % случаев сопровождается появлением зон гипоперфузии, области гиперперфузии ткани мозга выявляются реже.
Метод ПЭТ применяют для углубленного изучения эпилепсии, уточнения особенностей церебрального метаболизма и кровообращения в эпилептогенном очаге. Разработаны критерии показаний к хирургическому лечению эпилепсии. Перспективно использование ПЭТ для исследования опухолей головного мозга, сосудистых мальформаций. Достижением последнего времени является изучение особенностей метаболизма при наличии нервно-психических заболеваний. ПЭТ, невзирая на необходимость проведения исследований вблизи циклотрона (в связи с использованием недолгосуществующих изотопов), имеет большие перспективы в клинике как исключительно информативный и безопасный метод изучения функций головного мозга.
Перфузию ткани можно оценивать, используя и другие радиологические методики: однофотонную эмиссионную компьютерную томографию (ОФЭКТ), ксеноновую КТ, МРТ, транскраниальную перфузионную допплерографию.
Date: 2015-07-02; view: 1044; Нарушение авторских прав