
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота 5
|
|
АЛКЕНИ
Будова, ізомерія, номенклатура, властивості
Вуглеводні з подвійним зв’язком називаються етиленовими (олефінами, ал-кенами). Вони мають загальну формулу СnН2n.
За міжнародною номенклатурою назву алкену утворюють таким чином: вибирають найдовший ланцюг вуглецевих атомів з подвійним зв’язком і закінчення алканів “-ан” замінюють на “-ен”. Відлік вуглецевих атомів починають з кінця, ближнього до подвійного зв’язку. Називають розгалуження, вказуючи цифрами їхнє розташування, потім основний ланцюг із закінченням “-ен“ і вказують цифрою місце, де починається подвійний зв’язок:
| Н2С = СН - СН3 | 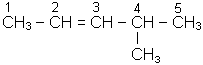
|
| пропен | 4-метилпентен-2 |
Молекули з двома подвійними зв’язками належать до класу алкадієнів, які називають, додаючи перед закінченням частку “ді-”:
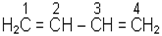
бутадієн - 1,3
Дуже часто алкени називають без урахування розгалуження (за винятком бути-лену), використовуючи закінчення “-илен”: С2Н4-етилен, С3Н6-пропілен, С4Н8-бутилен та ізобутилен (розгалужений вуглеводень), С5Н10-амілен або пентілен - так можна назвати будь-який з ізомерів С5Н10.
У всіх ненасичених вуглеводнів існують два види ізомерії: ланцюга і розта-шування кратного зв’язку. Крім того, етиленові вуглеводні, які мають різноманітні (щонайменше два) радикали біля атомів вуглецю, поєднаних подвійним зв’язком, можуть існувати у вигляді просторових ізомерів залежно від розташування радикалів щодо подвійного зв’язку. Цей вид ізомерії називається цис-транс-ізомерією, або геометричною. У цис-ізомера однакові радикали розташовані по один бік від площини подвійного зв’язку, у транс-ізомера - по різні.
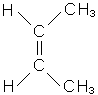
| 
|
| цис-бутен-2 | транс-бутен-2 |
Для ненасичених вуглеводнів характерні реакції приєднання (головним чином, електрофільного), окиснення і полімеризації.
У алкенів спостерігається в ІЧ-спектрах характерне поглинання при 3100, 1420 і 915 см-1 (=С-Н) і 1650 см-1 (валентні коливання -С=С-, коли подвійний зв’язок роз-міщується на кінці ланцюга).
Дослід 5.1. Отримання етилену і його горіння
| Реактиви та матеріали: | етиловий спирт (96%), сульфатна кислота (d=1,84 г/см3) |
| Обладнання: | пісок, газовідвідна трубка, пробірки, піпетки, паль-ник |
В суху пробірку вміщують декілька крупинок піску, 6 крапель етилового спирту і 8 крапель концентрованої сульфатної кислоти. Закривають пробірку пробкою з газо-відвідною трубкою і обережно нагрівають суміш на полум’ї пальника. Газ, який виді-ляється, підпалюють на кінці газовідвідної трубки - він горить світним полум’ям.
Хімізм процесу:
СН3 - СН2ОН + HOSO3H  CH3 - CH2 - OSO3H + H2O
CH3 - CH2 - OSO3H + H2O
етилсульфатна кислота
Етилсульфатна кислота - моноефір неорганічної двоосновної кислоти - при нагріванні розкладається:
СН3 - СН2 - OSO3H ® CH2 = CH2 + H2SO4
Таким чином, при взаємодії етилового спирту з сульфатною кислотою відбу-вається дегідратація спирту:
СН3 - СН2 - ОН ® СН2 = СН2 + Н2О
Етилен, що виділяється, горить світним полум’ям:
С2Н4 + 3О2 ® СО2 + 2Н2О
Концентрована сульфатна кислота - окиснювач. При нагріванні суміші спирту з концентрованою сульфатною кислотою утворюється, крім етилену і слідів діетилового ефіру (С2Н5)2О, ряд продуктів окиснення органічних сполук, наприклад, СО2, вугілля С (суміш у пробірці чорніє). Сульфатна кислота при цьому відновлюється вуглецем до діоксиду сірки:
2Н2SO4 + C ® CO2 + 2SO2 + 2H2O
Діоксид сірки також може знебарвити розчини брому і перманганату калію подібно етилену. Тому звичайно отриманий етилен промивають розчином лугу для очищення від SO2. Якщо реакцію здійснювати в присутності піску, сульфату алюмінію (каталізаторів, які прискорюють дегідратацію спирту), то суміш не чорніє, отже, ді-оксид сірки не утворюється. Дегiдратацiя спиртiв є загальним способом отримання ненасичених вуглеводнiв.
Дослiд 5.2. Приєднання до етилену брому
| Реактиви та матеріали: | етилен, бромна вода (насичений розчин) |
| Обладнання: | пробiрки, пальник, піпетка |
Не припиняючи нагрiвання пробiрки, в якiй знаходиться сумiш спирту i сульфатної кислоти, опускають кiнець газовiдвiдної трубки в пробiрку з п’ятьма краплями бромної води. Бромна вода швидко знебарвлюється внаслiдок приєднання атомiв брому на мiсцi подвiйного зв’язку.
Хiмiзм процесу:
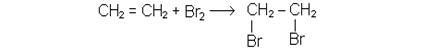
Для алкенiв ця реакцiя служить якiсною реакцiєю на подвiйний зв’язок.
Дослiд 5.3. Взаємодiя з окиснювачами
| Реактиви та матеріали: | етилен, перманганат калiю (0,1Н розчин) |
| Обладнання: | пробiрки, пальник, піпетка |
Не припиняючи нагрiвання пробiрки, в якiй знаходиться сумiш спирту i сульфатної кислоти, опускають кiнець газовiдвiдної трубки в пробiрку з однiєю краплею розчину перманганату калiю i чотирма краплями води. Розчин перманганату калiю швидко знебарвлюється. При цьому алкен окиснюється до двохатомного спирту.
Хiмiзм процесу:
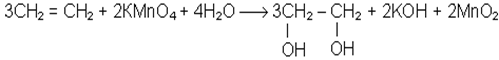
Ця реакцiя також є якiсною на подвiйний зв’язок.
Дослiд 5.4. Приєднання галогенів й галогеноводнів за кратним ланцюгом
Галогени можуть приєднуватися до ненасичених сполук жирного ряду без каталізаторів з утворенням віцинальних галогенопохідних. Ця реакція протікає за механізмом електрофільного приєднання:
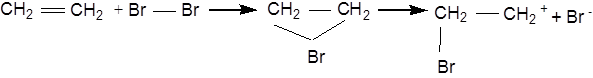
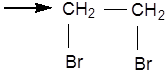
Галогенування вуглеводнів із супряженими подвійними зв'язками призводить до утворення ізомерних ненасичених дигалогенідів:
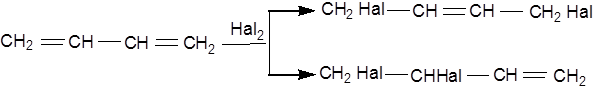
Галогеноводні легко приєднуються до подвійних зв'язків.При цьому утворюються галогеналкіли. Легше за все приєднується йодистий водень; найважче ─ хлористий водень.
У випадку несиметрично побудованого олефіну, наприклад пропілену, можливі два випадки реакції:
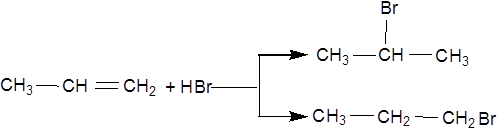
Реакція приєднання йде головним чином за напрямком 1, у відповідності за правилом Марковникова, відповідно до якого атом водню приєднується до більш гідрогенізованого, а атом галогену – до менш гідрогенізованого атома карбону. Особливо легко відбувається приєднання у тих випадках, коли утворюється третинний галогеналкіл.
Взаємодія олефінів з галогеноводнями належить до числа реакцій електрофільного приєднання й протікає за схемою:
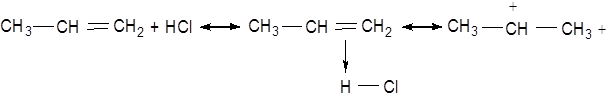

Бромистий водень приєднується за правилом Марковникова тільки при відсутності радикальних реакцій. В іншому випадку бромистий водень приєднується навпаки правилу Марковникова за механізмом радикальних ланцюгових реакцій (перекисний ефект Хараша). Наприклад:
R· + HBr → RH + Br·
(R – ініціюючий радикал)
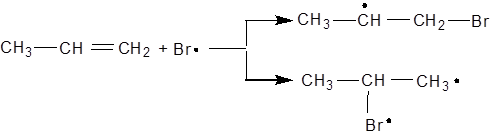
Процес йде в бік утворення більш стійкого вторинного радикалу, який далі взаємодіє з бромистим воднем:

До сполук з потрійним зв'язком галогеноводні приєднуються також за правилом Марковникова. При приєднанні однієї молекули галогеноводню отримують моногалогенопохідні, що містять галоген у подвійного зв'язку:

Приєднання другої молекули призводить до гемінального дигалогенпохідного:
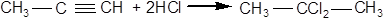
При приєднанні бромистого водню за потрійним зв'язком може також спостерігатися перекисний ефект Хараша.
Приєднання галогеноводнів до спряжених дієнових з'єднань йде у двох напрямках:
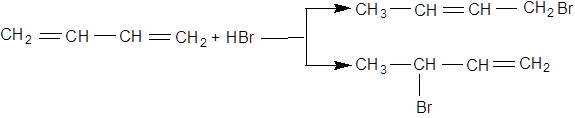
й призводить до утворення ізомерних ненасичених галогенопохідних.
Перша стадія відбувається з приєднанням протону до одного з крайніх карбонових атомів спряженої системи. При цьому утворюється спряжно-карбоновий іон, який потім приєднує аніон в положеннях 2 й 4:
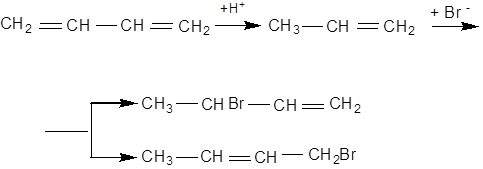
Приєднання галогенопохідних кислот до акролеїну відбувається не за правилом Марковникова внаслідок впливу карбонільної групи:
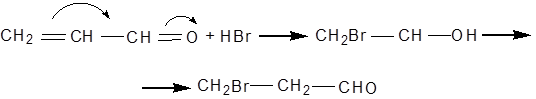
Дослiд 5.5. Окиснення ненасичених вуглеводнів
Ациклічні вуглеводні окиснюються повітрям у рідкій фазі (140-150°С) в присутності солей кобальту або мангану. При окисненні циклогексану утворюються циклогексан й циклогексанон.
Етиленові вуглеводні дуже чутливі до дії окисників. Будова продуктів окиснення визначається природою окисника. При дії кисню на етиленові вуглеводні в рідкій фазі подвійний зв'язок не використовується. Окисненню підлягає група, що знаходиться в α-положенні до подвійного зв'язку, при цьому утворюється гідроксид:
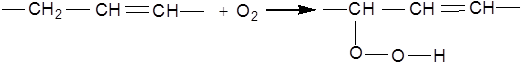
Каталітичне окиснення ненасичених вуглеводнів застосовується для отримання α-оксидів. Окиснення етилену киснем повітря над дрібнороздробленим сріблом при 270-290°С призводить до утворення оксиду етилену:
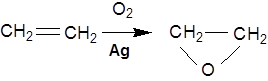
При дії марганцевокислого калію в нейтральному або лужному розведеному водному розчині на етиленові вуглеводні утворюється α-гліколі:
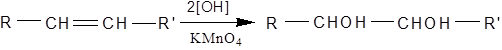
При цьому спостерігається знебарвлення лужного розчину перманганату й осадження MnO2. Дана реакція використовується як якісна на подвійний зв'язок.
Реакція Вагнера йде через стадію утворення циклічного ефіру. Механізм утворення гліколю можна подати такою схемою:
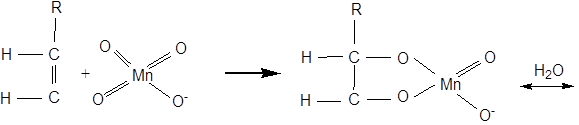
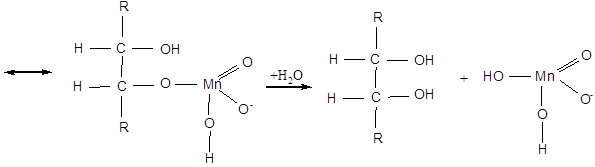
При більш енергійному окисненні (KMnO4 в кислому розчині, HNO3, хромова суміш) відбувається розрив за подвійним зв'язком та в залежності від будови ненасичені сполуки утворюються кислоти або кетони й кислота:
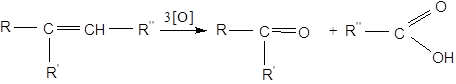
Цей метод дає можливість отримувати гліколі, кетони й кислоти з ненасичених вуглеводнів, а також встановлювати їхню будову. Для окиснювального розщеплення етиленових вуглеводнів використовується реакція озонування. Реакція озонування використовується для встановлення будови сполуки з подвійним зв'язком.
| Реактиви та матеріали: | рідкі алкени, перманганат калію KMnO4, 0,1Н розчин, карбонат натрію Na2CO3, 1Н розчин. |
У пробірку вводять 1 краплю рідкого алкену, 1 краплю розчину вуглекислого натрію й додають при енергійному струшуванні 2-3 краплі розчину перманганату калію. Фіолетовий колір зникає, й з'являється коричневе забарвлення від утвореного діоксиду марганцю:
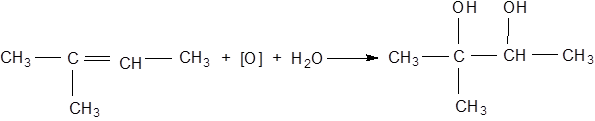
2-метил-2,3-бутандіол
Реакція окиснення алкенів перманганатом калію в нейтральному або лужному водних розчинах є аналітичною реакцією на подвійний зв'язок. У більш жорстких умовах – у кислому середовищі при нагріванні – відбувається розщеплення молекули за подвійним зв'язком. За продуктами окиснення встановлюють структуру алкену й положення подвійного зв'язку.
Дослiд 5.6. Дія концентрованої сульфатної кислоти на ненасичені вуглеводні
| Реактиви та матеріали: | рідкі алкени, сульфатна кислота (d=1,84 г/см3). |
У пробірку вміщують 2 краплі рідкого алкену й 2 краплі сульфатної кислоти. Вміст пробірки добре перемішують протягом 1-2 хв, охолоджуючи пробірку холодною проточною водою. Суміш розігрівається, шар алкену зникає.
Хімізм процесу:
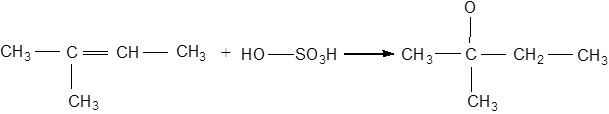
2-метил-2-бутен ізоамілсульфатна кислота
Сульфатна кислота взаємодіє з алкенами з утворенням алкілсульфатних кислот. Цю реакцію застосовують в газовому аналізі для виділення газоподібних алкенів із суміші з іншими газами й для отримання спиртів.
Дослiд 5.7. Дія концентрованої нітратної кислоти на ненасичені вуглеводні
| Реактиви та матеріали: | рідкі алкени, нітратна кислота (d=1,4 г/см3). |
У пробірку вміщують 2 краплі досліджуваного алкену й додають 2 краплі нітратної кислоти. Вміст пробірки струшують протягом хвилини. Суміш розігрівається й стає бурою. У результаті реакції утворюється складна суміш, що містить смолоподібні продукти.
Алкени здатні також приєднувати вищі оксиди азоту й хлористий нітрозил ClNO з утворенням нітрозитів й нітрозохлоридів:
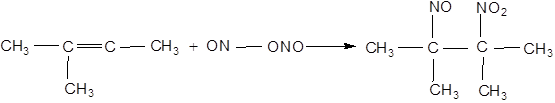
нітрозит тетраметилетилену
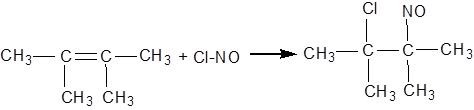
нітрозохлорид тетраметилетилену
Контрольнi запитання
1. Напишiть структурнi формули таких вуглеводнів: а) 5-метилгептен-3; б) 4,4-ди-метилпентен-2; в) 2,3,3-триметилпентен-1; г) 2,4-диметилпентен-1. Назвiть їх.
2. Напишіть структурні формули ізомерних ациклічних вуглеводнів складу С6Н12. Назвіть їх.
3. На прикладi пояснiть правило Зайцева.
4. Отримайте 4-метилпентен-2 iз 4-метилпентену-1. 4-метилпентен-2 окиснiть кон-центрованим розчином KMnO4.
5. Отримайте будь-яким способом 2-метилбутен-1. Напишiть для нього рiвняння реакцii з KMnO4.
6. Якi вуглеводнi отримують при дiї цинку на дигалогенпохiднi: 2,3-дибромпентан; 2,3-дибром-2-метилпентан?
7. Напишіть реакції приєднання: а) НВr до пропену; б) НСl до 2,2-диметилпентену-3.
Date: 2015-07-02; view: 1426; Нарушение авторских прав