
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота 4
|
|
НАСИЧЕНІ ВУГЛЕВОДНІ
Будова, ізомерія, номенклатура, властивості
Вуглеводнями називають сполуки, які складаються з атомів вуглецю та водню. Вуглеводні діляться на насичені та ненасичені.
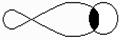
Насичені вуглеводні (алкани, парафіни) мають тільки прості (одинарні) зв’язки між атомами вуглецю, ненасичені мають і кратні зв’язки - подвійні та потрійні. Будь-який простий зв’язок між атомами вуглецю й іншими (у тому числі атомом вуглецю) називається s-зв’язком: для нього характерне перекриття електронних орбіталей уздовж лінії, яка з’єднує центри атомів, що взаємодіють. В утворенні s-зв’язку з боку атома вуглецю завжди бере участь гібридна sp-, sp2- або sp3-орбіталь. Один із кратних зв’язків вуглецевого атома в різних сполуках є s-зв’язком. Інші зв’язки, утворені не гібридними, а р-орбіталями, називаються p-зв’язками. Вони утворюються за рахунок перекривання р-орбіталей по обидва боки лінії, яка з’єднує центри атомів: вони менш міцні, ніж s-зв’язки і більш рухомі.
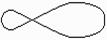
| 
| 
|
| гібридна орбіталь вуглецевого атома (sp3-, sp2-, sp-) | s - зв’язок С-Н | s - зв’язок С-С |

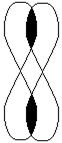
| 
|
| р - орбіталь | p - зв’язок |
π - зв’язок в етилені розташований в площині, перпендикулярній площині роз-ташування s-зв’язків. В ацетилені є два p-зв’язки, які знаходяться в двох взаємно
перпендикулярних площинах.
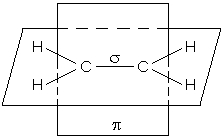
| 
|
Спільна формула насичених вуглеводнів - СnH2n+2. Алкани мають суфікс -ан, а радикали -ил (іл).
Гомологічний ряд
| Алкани | Алкіли | ||
| СН4 С2Н6 С3Н8 С4Н10 С5Н12 С6Н14 С7Н16 С8Н18 С9Н20 С10Н22 С11Н24 С12Н26 | метан етан пропан бутан пентан гексан гептан октан нонан декан ундекан додекан | -СН3 -С2Н5 -С3Н7 -С4Н9 -С5Н11 -С6Н13 -С7Н15 -С8Н17 -С9Н19 -С10Н21 -С11Н23 -С12Н25 | метил етил пропіл бутил пентил гексил гептил октил ноніл децил ундецил додецил |
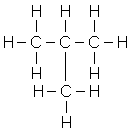
Ізомерія насичених вуглеводнів залежить від структури вуглецевого скелета (ізомерія ланцюга, або ізомерія скелета). Бутан - найпростіший представник наси-чених вуглеводнів, який може існувати у вигляді ізомерів:
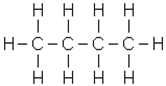
| 
|
| бутан | ізобутан |
Ізомерія алкільних радикалів починається з радикала С3Н7-:
| СН3 - СН2 – СН2 - | 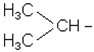
|
| пропіл | ізопропіл |
Радикали С4Н9- можуть існувати у вигляді 4-х ізомерів
| СН3 - СН2 - СН2 - СН2 - | 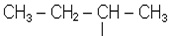
|
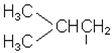
| н-бутил | втор-бутил |
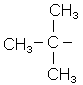
| 
|
| трет-бутил | ізобутил |
Назва втор-бутил пов’язана з тим, що цей радикал має вільну валентність у вуглецевого атома, що з’єднується з двома сусідніми атомами вуглецю. В радикалах бутил і ізобутил вільна валентність в обох випадках знаходиться біля первинного вуг-лецевого атома (пов’язаного з одним сусіднім атомом вуглецю). Тоді радикал, який має нерозгалужений ланцюг, називається нормальний бутил, а розгалужений - ізо-бутил.
Прийнято префікс “ізо” приєднувати до назви радикалів, у яких дві метильні
групи знаходяться на кінці нерозгалуженого ланцюга:
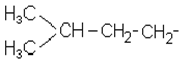
ізопентил
Для назви вуглеводнів з розгалуженим ланцюгом використовуються дві номен-клатури. Одна умовно називається раціональною (РН), за основу беруть найпрості-ший вуглеводень - метан: називають в порядку ускладнення радикали, які розташо-вані біля атома вуглецю, прийнятого за залишок метану, потім додають слово “метан”.
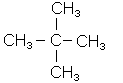
Більш новою і досконалою є друга номенклатура, що називається міжнарод-ною, або IUPAC. Згідно з нею за основу береться назва алкану, що відповідає найдовшому в молекулі ланцюгу вуглецевих атомів (не враховуючи розгалужень). Ланцюг нумерують з того кінця, до якого ближче розгалуження: вказують цифрами положення радикалів, потім їх назву і завершують назвою вуглеводню, взятого за основу:
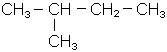
| 
| 
|
| 2-метилбутан | 2,2-диметилпропан | 2-метил-3-етилпентан |
Дослід 4.1. Синтез метану та вивчення його властивостей
| Реактиви та матеріали: | оцтовокислий натрій, натронне вапно, бромна вода, перманганат калію (1Н розчин) |
| Обладнання: | пробірки, газовідвідна трубка, пальник |
В суху пробірку 1, обладнану пробкою з газовідвідною трубкою (рис. 4.1), кладуть суміш зневодненого оцтовокислого натрію і натронного вапна (приблизно 1:2, висота шару 6-10 мм). Натронне вапно (суміш їдкого натру і оксиду кальцію) беруть тому, що чистий їдкий натр роз’їдає скло при нагріванні. Крім того, натронне вапно не плавиться при нагріванні і завдяки його пористості полегшується виділення метану.
Хімізм процесу:
СН3СООNa + NaOH ® CH4 + Nа2CO3

Рис. 4.1. Синтез метану з оцтовокислого натрію
Підпалюють метан, який виходить з кінця газовідвідної трубки, він горить голубуватим несвітним полум’ям.
Хімізм процесу:
СН4 + 2О2 ® СО2 + 2Н2О
Таким чином, при нагріванні натрієвої солі оцтової кислоти з натронним вапном сіль розщеплюється з утворенням метану. Нагрівання натрієвих солей карбонових кислот з натронним вапном є загальним лабораторним способом отримання на-сичених вуглеводнів.
Реакція метану на бромну воду і перманганат калію
В суху пробірку вміщують 5 крапель розчину перманганату калію (або бромної води). Не припиняючи нагрівання суміші в пробірці 1 (рис. 4.1), вводять кінець газовідвідної трубки в пробірку 2 з перманганатом (або бромною водою). Знебарвлювання розчинів перманганату калію й бромної води не відбувається. В звичайних умовах алкани стійкі до дії окислювачів. Реакції заміщення у них відбуваються в жорстких умовах, а до реакції приєднання алкани не здатні.
Дослід 4.2. Галогенування насичених вуглеводнів
Хлорування й бромування відбуваються з виділенням теплоти за рівнянням
RH + Hal → RHal + HHal - ∆H
Це радикальні ланцюгові процеси. Вони ініціюються світлом, нагріванням й речовинами, легко відщеплюються на вільні радикали. Наприклад, механізм хлорування метану може бути представлений такою схемою:
Cl2→ 2Cl зародження ланцюга
СH4 + Cl2 → CH3Сl + HCl
CH3Сl + Cl2 → CH2Cl2 і т.д.
Обрив ланцюга відбувається в результаті спаровування або захвату радикалів стінкою посудини, взаємодії їх з інгібіторами радикальних реакцій,що випадково знаходяться або спеціально введеними в реакційну масу.
При хлоруванні гомологів метану заміщення гідрогену відбувається легше за все при третинному атомі карбону, важче ─ при вторинному й ще важче ─ при первинному. Хлорування метану й його гомологів утворенням суміші моно- й полігалогенідів. Бромування протікає повільніше, але вибірково, ніж хлорування. Йод з насиченими вуглеводнями не реагує.
Взаємодія фтору з вуглеводнями протікає дуже бурхливо й може призвести до вибуху; супроводжується не тільки заміщенням водню, але й крекінгом карбонового ланцюга. Це обумовлено значною величиною теплового ефекту фторування (481 кДж/моль).
Дослід 4.3. Бромування насичених вуглеводнів
| Реактиви та матеріали: | рідкі алкани, розчин брому в органічному розчинни-ку, аміак (25%-ний розчин), синій лакмусовий папі-рець |
| Обладнання: | пінцет, скляна паличка, пробірки, пальник |
Увага! Дослід проводити у витяжній шафі.
У суху пробірку вміщують 4 краплі суміші рідких алканів і додають 1-2 краплі розчину брому. Суміш перемішують на холоді. Забарвлення брому при цьому не зникає. Потім пробірку нагрівають до зникнення забарвлення. В отвір пробірки вносять скляну паличку, змочену розчином аміаку, - з’являється білий димок NH4Br. Пінцетом вносять у пробірку змочений водою лакмусовий папірець - він червоніє.
Хімізм процесу:
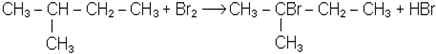
2-бром-2-метилбутан
Бромування рідких алканів супроводжується виділенням бромистого водню і відбувається значно повільніше, ніж газоподібних алканів. Реакція прискорюється при використанні каталізаторів: залізних ошурок, кристалічного йоду.
Найлегше галогенуються вуглеводні з третинним атомом вуглецю в молекулі, найважче заміщуються атоми водню при первинному атомі вуглецю. Енергія s-зв’язку водню з первинним атомом вуглецю дорівнює 99 ккал/моль; вторинним - 94 ккал/моль (389 кДж/моль); третинним - 90 ккал/моль (376,8 кДж/моль). Різниця в швидкості реакції галогенування особливо виявляється при дії брому.
Реакції окиснення широко використовуються в органічній хімії для синтезу різних кисневмісних з'єднань.
Механізм окиснення в залежності від природи окисника, субстрату й умов проведення реакції може бути різним.
Загальні положення про окисники
Існує великий вибір сполук, що застосовуються як окиснювачі: перманганат калію, хромовий ангідрид та хромова суміш, нітратна кислота, діоксиди свинцю й діоксиди селену, тетраацетат свинцю, пероксид водню, хлорне залізо та багато інших. Напрям й інтенсивність дії окисника на органічні з'єднання залежить від характеру окиснювальної речовини, природи окисника, температури, рН середовища та ін.
Перманганат калію. Для окиснення застосовують водні розчини перманганату калію різної концентрації в нейтральному, кислому або лужному середовищах.
З'єднання шестивалентного хрому. У лабораторії застосовують для окиснення хромовий ангідрид звичайно у вигляді розчину в оцтовій кислоті, в якій добре розчиняється також більшість органічних сполук, дихромати – у вигляді розчинів в розведеній сульфатній кислоті. Окиснення проводять як на холоді, так й при нагріванні. Забарвлення реакційної суміші в зелений колір вказує на закінчення реакції. Майте на увазі, що Na2Cr2O7·2H2O значно більш розчинний у воді й у льодяній оцтовій кислоті, ніж K2Cr2O7.
Нітратна кислота. Для окиснення застосовують нітратну кислоту різної концентрації (10-65%). Рідкі органічні сполуки окиснюють без розчинників, тверді – в розчинниках (оцтова кислота, хлорбензол), що стійкі до дії нітратної кислоти. Нітратна кислота має сильні окисні властивості. Окиснення проводять як на холоді, так й при нагріванні.
Діоксид селену. Окиснення звичайно проводять в спирті, оцтовій кислоті або суміші оцтової кислоти з бензолом. Окисник розчиняють в органічному розчиннику або в невеликій кількості гарячої води, в останньому випадку окисником є селенітна кислота H2SeO3. У процесі реакції утворюється червоний осад селену.
Тетраацетат свинцю. Його отримують нагріванням сурику з оцтовою кислотою. Окиснення проводять в розчині льодяної оцтової кислоти. При холодному окисненні тетраацетат свинцю переходить в ацетат свинцю (ІІ).
Пероксид водню. Для окиснення застосовують водні розчини пероксиду водню різної концентрації в нейтральному, кислому й лужному середовищах.
Окиснення відбувається по радикальному механізму. Окиснення в нейтральному середовищі проводять в присутності оксиду заліза (ІІ). Останній взаємодіє з Н2О2 за рівнянням:
Н2О2 + Fe2+ → HO- + HO* + Fe3+
Кисень повітря. Кисень повітря – дешевий окисник, широко застосовується в технологічних процесах. Окиснення проводять при підвищеній температурі як без каталізаторів, так і в присутності каталізаторів, якими є окисиди й солі металів зі змінною валентністю (Cu, Mn, Pb, V та ін.).
Окиснення парафінів
Насичені вуглеводні (парафіни) дуже стійкі до дії таких сильних окиснювачів, як перманганат калію і хромова суміш. Окиснюються в газовій фазі, утворюючи суміш нижчих спиртів, альдегідів, кетонів і кислот. Цей метод використовується для отри-мання формальдегіду.
При температурі вище 300°С насичені вуглеводні горять з утворенням СО2 і Н2О:
С5Н12 + 8О2 ® 5СО2 +6Н2О
При більш високих температурах у промисловості відбувається процес взаємо-дії метану з водою:
СН4 +Н2О ® СО + 3Н2
При окисненні вищих парафінів киснем повітря в присутності діоксиду марганцю при 100°- 160°С утворюється складна суміш, в якій є вищі жирні кислоти. Ці окисні процеси застосовуються в промисловості. Із утвореної суміші кислот виділяють кислоти та отримують з них мило.
Окиснення являє собою радикальну ланцюгову реакцію, в процесі якої утворюються гідропероксиди:
RH + ·O – O. → R· + H – O – O·
R· + · O – O· → R – O – O·
R – O –O· + RH → R – O –O –H + R· і т.д.
Дія кисню спрямовується на третинний атом карбону, потім на вторинний та на первинний. Гідропероксиди в залежності від будови карбонового радикалу й умов проведення окиснення розкладаються по-різному. Розклад гідропероксидів відбувається з утворенням спиртів, альдегідів та кетонів.
Дослід 4.4. Окиснення алканів
| Реактиви та матеріали: | суміш алканів, вуглекислий натрій, перманганат калію |
| Обладнання: | пробірки, піпетки |
У пробірку відбирають 1 краплю алкану або суміші алканів, 1 краплю вуглекислого натрію і 2-3 краплі розчину перманганату калію. Суміш енергійно перемішують, фіолетовий колір водного шару не змінюється, бо алкани в цих умовах не окиснюються.
Дослід 4.5. Дія концентрованої сульфатної кислоти на насичені вуглеводні
| Реактиви та матеріали: | рідкі алкани, сульфатна кислота концентрована (d= 1.84 г/см)3. |
У пробірку вміщують 2 краплі рідкого алкану й 2 краплі сульфатної кислоти. Вміст пробірки енергійно перемішують 1-2 хв, охолоджуючи пробірку проточною водою. В умовах досліду алкани з сульфатною кислотою не реагують.
При невеликому нагріванні сульфатна кислота утворює з алканами, що мають третинний атом карбону, сульфокислоти. При високих температурах сульфатна кислота діє як окисник.
Дослід 4.5. Дія концентрованої нітратної кислоти на насичені вуглеводні
| Реактиви та матеріали: | рідкі алкани, нітратна кислота концентрована (d= 1,4 г/см3.) |
У пробірку вміщують 2 краплі досліджуваного алкану й додають 2 краплі нітратної кислоти. Суміш перемішують на протязі 1-2 хв. Ніякої зміни в пробірці не відбувається.
Концентрована нітратна кислота на холоді не реагує з алканами, при високій температурі вона діє як окисник. Реакція нітрування алканів йде добре з розведеною нітратною кислотою при нагріванні та підвищеному тиску. Легше за все нітруються алкани, що мають в молекулі третинний карбоновий атом. Алкани легко нітруються в газовій фазі діоксидом азоту або парами нітратної кислоти при 250-500°С. Ця реакція йде за радикальним механізмом.
Контрольні запитання
1. Напишіть структурні формули вуглеводнів: а) 2,5-диметилгексан; б) 3-метил-3-етилпентан; в) 2-метил-4-ізопропілгептан; г) 3-етилундекан; д) 2,4-диметил-4-етил-октан.
2. Напишіть структурні формули ізомерних вуглеводнів складу С6Н14. Назвіть їх. Вкажіть ізомери з третинними атомами вуглецю.
3. Які вуглеводні утворюються при дії металічного натрію на суміш: а) йодистого метилу і йодистого ізобутилу; б) йодистого етилу і йодистого ізопропілу; в) йо-дистого пропілу і бромистого ізоамілу?
4. Напишіть структурну формулу органічної речовини складу С5Н12, якщо відомо, що при її хлоруванні утворюється переважно третинне хлорпохідне, а при нітруванні - третинна нітросполука. Поясніть, чому заміщення найлегше відбувається у тре-тинного атома вуглецю.
5. Напишить схеми отримання ізобутану (будь-яким способом) і його нітрування.
6. Перетворіть бромистий ізобутил у насичений вуглеводень: з тією ж будовою ву-глецевого скелета; з подвійним числом вуглецевих атомів.
Date: 2015-07-02; view: 1535; Нарушение авторских прав