
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

II. Препараты различных фармакологических групп с анальгетическим компонентом действия
|
|
Представители разных групп неопиоидных веществ могут обладать достаточно выраженной анальгетической активностью. Одним из таких препаратов является α2-адреномиметик клофелин, применяемый в качестве антигипертензивного средства (см. главу 14; 14.4). В экспериментах на животных было показано, что по анальгетической активности он превосходит морфин. Анальгетический эффект клофелина связан с его влиянием на сегментарном и отчасти на супрасегментарном уровнях и проявляется в основном при участии α2-адренорецепторов. Препарат угнетает реакцию на боль со стороны гемодинамики. Дыхание не угнетает. Лекарственной зависимости не вызывает.
Клинические наблюдения подтвердили выраженную болеутоляющую эффективность клофелина (при инфаркте миокарда, в послеоперационном периоде, при болях, связанных с опухолями, и т.д.). Применение клофелина лимитируется его седативным и гипотензивным свойствами. Вводят обычно под оболочки спинного мозга.
Анальгетическая активность выражена также у трициклических антидепрессантов амитриптилина и имизина (см. главу 11; 11.2). Очевидно, механизм их анальгетического действия связан с угнетением нейронального захвата серотонина и норадреналина в нисходящих путях, контролирующих проведение ноцицептивных стимулов в задних рогах спинного мозга. Указанные антидепрессанты эффективны главным образом при хронических болях. Однако в сочетании с некоторыми антипсихотическими средствами (например, фторфеназином) они применяются также при сильных болях, связанных с постгерпетической невралгией, и при фантомных болях.
Болеутоляющее действие характерно для азота закиси, применяемой для ингаляционного наркоза. Эффект проявляется в субнаркотических концентрациях и может быть использован для купирования сильных болей в течение нескольких часов (см. главу 5; 5.1.2).
Выраженный анальгетический эффект вызывает и фенциклидиновое производное кетамин (см. главу 5; 5.2), применяемый для общего обезболивания (для так называемой диссоциативной анестезии). Является неконкурентным антагонистом глутаматных NMDA-рецепторов.
Отдельным противогистаминным средствам, блокирующим гистаминовые Н1-рецепторы, также присущи анальгетические свойства (например, димедролу). Не исключено, что гистаминергическая система принимает участие в центральной регуляции проведения и восприятия боли. Однако ряд противогистаминных средств имеет более широкий спектр действия и может оказывать влияние и на другие системы медиаторов/модуляторов боли.
Болеутоляющей активностью обладает и группа противоэпилептических средств, блокирующих натриевые каналы, — карбамазепин, натрия вальпроат, дифенин, ламотриджин, габапептин и др. (см. главу 9). Применяют их при хронических болях. В частности, карбамазепин понижает болевые ощущения при невралгии тройничного нерва. Габапептин оказался эффективным при нейропатических болях (при диабетической нейропатии, постгерпетической и тригеминальной невралгии, мигрени).
Анальгетическое действие установлено и у некоторых агонистов ГАМК-рецепторов (баклофен, THIP).
Анальгетические свойства отмечены также у соматостатина и кальцитонина.
Естественно, что поиск высокоэффективных неопиоидных анальгетиков центрального действия с минимальными побочными эффектами и лишенных наркогенной активности представляет особенно большой интерес для практической медицины.
8.3. АНАЛЬГЕТИКИ СО СМЕШАННЫМ МЕХАНИЗМОМ ДЕЙСТВИЯ (ОПИОИДНЫЙ + НЕОПИОИДНЫЙ)
К этой группе веществ относится трамадол (трамал). Он взаимодействует с опиоидными рецепторами, а также влияет на моноаминергическую систему, участвующую в регуляции проведения болевых стимулов. Аффинитет к опиоидным рецепторам значительно меньше, чем у морфина. Неопиоидный компонент анальгезии, очевидно, связан с уменьшением нейронального захвата серотонина и норадреналина. Одним из проявлений этого эффекта служит усиление спинальных тормозных серотонинергических и адренергических влияний на межнейронную передачу ноцицептивных импульсов.
Трамадол в 5-10 раз менее активен, чем морфин, однако по анальгетической эффективности при применении в средних терапевтических дозах сопоставим с агонистами опиоидных рецепторов. Мало влияет на дыхание и функции пищеварительного тракта. Наркогенный потенциал у него значительно меньше, чем у агонистов опиоидных рецепторов.
Хорошо всасывается из кишечника. Биодоступность ~ 68%. При внутривенном введении анальгезия развивается через 5-10 мин, а при энтеральном — через 30-40 мин. Продолжительность действия 3-5 ч. Метаболизируется в печени. Метаболит О-дезметилтрамадол в 2-4 раза активнее трамадола. Выводятся трамадол и его метаболиты почками.
Препарат применяется при средних и сильных хронических и острых болях. Вводят внутрь, ректально и внутривенно 4 раза в сутки.
Из побочных эффектов возможны головная боль, головокружение, заторможенность, снижение скорости двигательных реакций, усиление потоотделения, гипотензия, тахикардия, сухость во рту, запор, боли в области живота, кожные высыпания; при введении в больших дозах иногда возникают судороги.
Слабым антидотом трамадола является налоксон.
| Препараты | ||
| Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
| Опиоидные (наркотические) анальгетики | ||
| Морфина гидрохлорид — Morphini hydrochloridum | Под кожу, внутримышечно, внутрь 0,01 г | Ампулы и шприц-тюбики по 1 мл 1% раствора |
| Промедол — Promedolum | Внутрь 0,025 г; под кожу 0,01-0,02 г | Порошок; таблетки по 0,025 г; ампулы и шприц-тюбики по 1 мл 1% и 2% раствора |
| Фентанил — Phentanylum | Внутримышечно и внутривенно 0,00005-0,0001 г | Ампулы по 2 и 5 мл 0,005% раствора |
| Буторфанол — Butorphanol | Внутримышечно 0,001-0,004 г; внутривенно 0,0005-0,002 г | Ампулы по 1 мл, содержащие 0,002 г вещества |
| Бупренорфин — Buprenorphine | Внутрь и сублингвально по 0,0002 г; внутримышечно 0,0003 г/кг | Таблетки по 0,0002 г; ампулы по 1 и 2 мл 0,03% раствора |
| Анальгетики смешанного механизма действия | ||
| Трамадол — Tramadol | Внутрь, ректально и парентерально по 0,05-0,1 г | Капсулы по 0,05 г, ампулы по 0,05-0,1 г, ректальные суппозитории по 0,1 г |
| Антагонист опиоидных анальгетиков | ||
| Налоксона гидрохлорид — Naloxoni hydrochloridum | Под кожу, внутримышечно и внутривенно 0,0004-0,008 г | Ампулы по 1 мл (0,4 мг/мл) |
| Неопиоидные (ненаркотические) анальгетики | ||
| Парацетамол — Paracetamol | Внутрь 0,2-0,4 г | Порошок; таблетки по 0,2 г, 0,325 и 0,5 г |
Глава 9 ПРОТИВОЭПИЛЕПТИЧЕСКИЕ СРЕДСТВА
Противоэпилептические средства применяют для предупреждения или уменьшения (по интенсивности и частоте) судорог или соответствующих им эквивалентов (потеря или нарушение сознания, поведенческие и вегетативные расстройства и др.), наблюдаемых при периодически возникающих приступах различных форм эпилепсии.
Механизм действия таких препаратов не совсем ясен, так как в большинстве случаев неизвестна этиология эпилепсии. По-видимому, одна из возможностей заключается в снижении веществами возбудимости нейронов эпилептогенного очага. Однако больше данных за то, что у основной группы противоэпилептических средств преобладает их угнетающее влияние на распространение патологической импульсации.
Наиболее вероятно, что первичные реакции, лежащие в основе противоэпилептического действия веществ, возникают на уровне нейрональных мембран. Имеются данные о том, что одни Противоэпилептические средства блокируют натриевые каналы (дифенин, карбамазепин), а другие активируют ГАМК-систему (фенобарбитал, бензодиазепины, натрия вальпроат). Кроме того, показано, что блокирование кальциевых каналов Т-типа (например, в таламусе) также является одним из механизмов понижения судорожной активности. Возможно, что по такому принципу действуют этосуксимид, триметин и частично натрия вальпроат. Привлекают внимание и вещества, подавляющие стимулирующее влияние глутаматергической системы. В качестве противосудорожных средств представляют интерес блокаторы разных подтипов глутаматных рецепторов, а также вещества, уменьшающие высвобождение глутамата из пресинаптических окончаний (например, ламотриджин). Каждая из этих групп характеризуется определенным спектром противоэпилептического действия. В экспериментах показано, что под влиянием противоэпилептических препаратов происходят увеличение рефрактерного периода, снижение лабильности, уменьшение некоторых следовых реакций и в целом угнетение межнейронной передачи возбуждения и ограничение распространения импульсации, генерируемой эпилептогенным очагом.
Угнетение противоэпилептическими веществами межнейронной передачи возбуждения может быть связано как с торможением процесса возбуждения нейронов, так и с усилением тормозных влияний, в том числе обусловленных стимуляцией тормозных нейронов.
Существует несколько судорожных и бессудорожных форм эпилепсии, каждая из которых характеризуется своеобразной клинической картиной и определенными изменениями на ЭЭГ (последнее имеет особенно большое диагностическое значение). Так, выделяют большие судорожные припадки (grand mal), психомоторные припадки, малые приступы эпилепсии (petit mal), миоклонус-эпилепсию и др.
Лечение каждой из форм эпилепсии проводят определенными противоэпилептическими средствами.
К противоэпилептическим средствам предъявляется ряд требований. Прежде всего эти средства, применяемые в основном для профилактики приступов эпилепсии, должны обладать высокой активностью и большой продолжительностью действия. Хорошая всасываемость из желудочно-кишечного тракта — одно из необходимых свойств таких препаратов. Желательно, чтобы они были эффективны при разных формах эпилепсии, что особенно важно при лечении смешанных ее форм. Седативный, снотворный и другие побочные эффекты неаллергической и аллергической природы крайне нежелательны, так как такие вещества принимают регулярно в течение многих месяцев и лет. При их использовании не должны возникать кумуляция, привыкание и лекарственная зависимость. Естественно, что для медицинской практики наиболее удобны препараты с малой токсичностью и большой широтой терапевтического действия. К сожалению, современные противоэпилептические средства отвечают лишь некоторым из этих требований.
Классифицируют противоэпилептические средства, обычно исходя из показаний к их применению при определенных типах судорог или их эквивалентов (табл. 9.1).
| Таблица 9.1 Применение противоэпилептических средств | |
| Тип судорог при эпилепсии | Препарат |
| Парциальные судороги | |
| Психомоторные припадки | Карбамазепин Дифенин Натрия вальпроат Фенобарбитал Гексамидин Клоназепам Габапептин Хлоракон Ламотриджин |
| Генерализованные судороги | |
| Большие судорожные припадки (grand mаl; тонико-клонические судороги) | Карбамазепин Фенобарбитал Дифенин Натрия вальпроат Ламотриджин Гексамидин |
| Эпилептический статус | Диазепам Лоразепам Клоназепам1 Фенобарбитал-натрий Дифенин-натрий Средства для наркоза |
| Малые приступы эпилепсии (petit mal) | Этосуксимид Клоназепам Натрия вальпроат Ламотриджин Триметин |
| Миоклонус-эпилепсия | Натрия вальпроат Клоназепам |
| 1 В растворах для парентерального введения. |
Появились предпосылки для классификации этих препаратов и по механизму действия. В принципе могут быть выделены следующие группы:
1) средства, угнетающие натриевые каналы;
2) средства, угнетающие кальциевые каналы (Т- и L-типа);
3) средства, активирующие ГАМК-ергическую систему;
4) средства, подавляющие центральные эффекты возбуждающих аминокислот.
Однако объем сведений по механизму действия противоэпилептических
средств недостаточен. Поэтому пока целесообразно ограничиться клинической классификацией этих препаратов, исходя из их эффективности при определенной симптоматике (см. табл. 9.1).
Основные лекарственные средства для предупреждения больших судорожных припадков эпилепсии — карбамазепин, дифенин, натрия вальпроат, фенобарбитал (см. табл. 9.1).
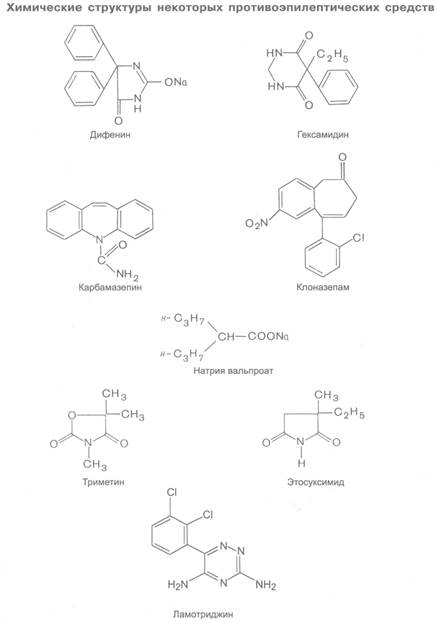
Фенобарбитал (люминал) является производным барбитуровой кислоты. Оказывает выраженное снотворное действие (см. главу 7; 7.2). Для лечения эпилепсии его используют в субгипнотических дозах. Механизм действия фенобарбитала заключается в активации ГАМК-ергической системы. Воздействуя на барбитуратный рецептор макромолекулярного ГАМКА-рецепторного комплекса, он повышает эффект ГАМК (см. главу 7). Эффективность фенобарбитала при эпилепсии связана, по-видимому, с его угнетающим влиянием на возбудимость нейронов эпилептогенного очага, а также на распространение нервных импульсов. Может наблюдаться седативное, а иногда и снотворное действие препарата. Следует учитывать, что у фенобарбитала выражена способность к кумуляции. При длительном его применении не исключена возможность развития привыкания и лекарственной зависимости.
Более избирательным противоэпилептическим эффектом обладает производное гидантоина дифенин (фенитоин, дифенилгидантоин, дилантин; см. структуру). Он угнетает натриевые каналы, пролонгирует время их инактивации и тем самым препятствует генерации и распространению высокочастотных разрядов. Последнее предупреждает развитие судорог.
Из желудочно-кишечного тракта дифенин всасывается хорошо. Биотрансформация его происходит в печени. Вместе с тем дифенин аналогично фенобарбиталу вызывает индукцию микросомальных ферментов печени. Продукты превращения дифенина и незначительная его часть в неизмененном виде выделяются из организма почками. Уменьшение содержания препарата в плазме крови на 50% происходит в течение 20-30 ч. Дифенин может кумулировать, но в значительно меньшей степени, чем фенобарбитал.
В отличие от фенобарбитала общего угнетающего действия на ЦНС дифенин не оказывает (в терапевтических дозах не вызывает сонливости, отсутствует или мало выражен седативный эффект). При применении дифенина могут наблюдаться нарушения нейрогенного происхождения (головокружение, атаксия, тремор, нистагм, диплопия и др.). Нередко отмечается гиперпластический гингивит (разрастание слизистой оболочки десен). Вследствие раздражающего действия дифенин может вызывать тошноту и рвоту. Возможны разнообразные кожные высыпания.
Вспомогательными средствами, применяемыми для лечения больших припадков, являются гексамидин, хлоракон.
Гексамидин (примидон) — производное пиримидина. По химической структуре сходен с фенобарбиталом (СО в остатке мочевины замещен на СН2; см. структуру).
Гексамидин не столь активен, как фенобарбитал, но менее токсичен. Может вызывать сонливость (но в меньшей степени, чем фенобарбитал), головокружение, головную боль, тошноту, атаксию, кожные высыпания и другие побочные эффекты.
К группе производных β-хлорпропионамида относится хлоракон (бекламид, хибикон). Он обладает выраженной противосудорожной активностью. Угнетает передачу импульсов с пирамидных и сегментарных спинальных путей на мотонейроны спинного мозга. Переносится больными хорошо, иногда может быть причиной диспепсических расстройств, головокружения.
Хлоракон и другие рассмотренные препараты в отдельных случаях могут оказывать отрицательное влияние на печень, костный мозг, почки. В связи с этим периодический контроль их функций является обязательным.
Противоэпилептический препарат топирамат (топамакс) является сульфат-замещенным моносахаридом. Имеются данные, что он блокирует потенциалзависимые натриевые каналы, а также усиливает действие ГАМК на ГАМКА-рецепторы. Кроме того, он ослабляет активацию глутаматных (каинатного подтипа) рецепторов.
Применяется при парциальных или генерализованных тонико-клонических судорогах.
Из побочных эффектов возможны нарушения функций ЦНС (атаксия, головокружение, утомляемость, сонливость и др.), гепатотоксическое действие, уролитиаз и пр.
При эпилептическом статусе (длительно не прекращающиеся большие судорожные припадки) лучший результат дает внутривенное введение бензодиазепиновых производных диазепама (сибазон), лоразепама и клоназепама. Механизм их действия связан с активацией ГАМК-ергической системы (см. главы 7 и 11.4).
Кроме того, можно воспользоваться парентеральным введением натриевых солей дифенина, фенобарбитала, а также назначением средств для ингаляционного и неингаляционного наркоза.
При психомоторных припадках применяют дифенин, гексамидин, хлоракон, а также фенобарбитал.
В последние годы широкое распространение при этой форме эпилепсии получил карбамазепин (стазепин, тегретол, финлепсин). По химической структуре он относится к производным дибензазепина. Его противосудорожную активность связывают с угнетением натриевых каналов. Преимуществом этого препарата является то, что противоэпилептический эффект сочетается у него с благоприятным психотропным действием. Последнее проявляется в том, что после приема карбамазепина у больных улучшается настроение, они становятся более общительными, деятельными, это облегчает их социальную и профессиональную реабилитацию.
Применяют карбамазепин также при больших судорожных припадках, смешанных формах эпилепсии, иногда при малых приступах эпилепсии.
При приеме карбамазепина могут отмечаться некоторые нежелательные явления, особенно в начале лечения. К ним относятся диспепсические расстройства, головная боль, головокружение, сонливость, нарушение аккомодации и др. Препарат угнетает психомоторные реакции, в связи с чем его не рекомендуют назначать водителям транспорта и представителям подобных профессий. Переносимость спирта этилового на фоне действия карбамазепина снижается.
При появлении аллергических реакций, лейкопении или тромбоцитопении препарат отменяют. В связи с возможностью последних двух осложнений необходим систематический контроль состава периферической крови.
Для лечения психомоторных припадков предложен новый аналог ГАМК — габапептин (нейронтин). Механизм действия его неизвестен. Препарату присуща также анксиолитическая и болеутоляющая активность.
Для предупреждения малых приступов эпилепсии используют главным образом этосуксимид, натрия вальпроат, а также клоназепам, ламотриджин и триметин.
Этосуксимид (суксилеп) относится к группе сукцинимидов. Блокирует кальциевые каналы Т-типа. Является препаратом выбора для профилактики малых приступов эпилепсии. Этосуксимид менее токсичен, чем триметин, однако при его использовании возникают (хотя и реже) те же серьезные нарушения со стороны кроветворения и функции почек. Кроме того, возможны диспепсические расстройства, головокружение, слабость, утомляемость. Контроль состава крови при лечении этосуксимидом обязателен.
Триметин (триметадион, тридион) является производным оксазолидина. Он угнетает полисинаптические рефлексы спинного мозга, снижает лабильность нейронов. На посттетаническое облегчение в сегментарных спинномозговых путях не действует. Не влияет на процесс активного выведения ионов натрия из нейронов, хотя и снижает его интрацеллюлярное содержание. Считают, что триметин блокирует кальциевые каналы Т-типа (см. главу 14.3), снижая интенсивность вхождения ионов кальция внутрь нейронов.
Триметин по нейрофармакологическим свойствам существенно отличается от дифенина. Отсутствие единого механизма действия у этих препаратов хорошо выявляется при их испытании на экспериментальных моделях эпилепсии, а также при клиническом применении. Так, дифенин активно устраняет у животных тоническую фазу судорог при максимальном электрошоке и не изменяет течения судорог, вызванных аналептиком каразолом. Триметин, напротив, мало влияет на судороги при максимальном электрошоке и очень активен при коразоловых судорогах. Показания к применению этих веществ также свидетельствуют о различиях в механизме их нейротропного действия. Как отмечалось, дифенин особенно эффективен при больших судорожных припадках, а триметин — при малых приступах эпилепсии, при которых дифенин не активен (фенобарбитал может даже ухудшить состояние больного).
Из желудочно-кишечного тракта триметин всасывается хорошо. Химические его превращения происходят преимущественно в печени. Образовавшиеся метаболиты выделяются почками.
Из побочных эффектов для триметина типичны седативное действие, гемералопия. Возможны и более тяжелые осложнения: аллергические поражения кожи, нарушения кроветворения (включая апластическую анемию и агранулоцитоз). Могут страдать функции печени и почек. В связи с этим при лечении триметином проводят систематический контроль состояния кроветворения, функции печени и почек.
При малых приступах с успехом применяется натрия вальпроат (см. ниже).
При малых приступах и других формах эпилепсии достаточно широко используют производное бензодиазепина клоназепам (антелепсин). По механизму действия и свойствам он аналогичен другим бензодиазепиновым соединениям (см. главы 7 и 11.4).
Одним из новых препаратов является ламотриджин (ламиктал). По химическому строению это производное фенилтриазина. Механизм его действия связывают с угнетением натриевых каналов, а также со снижением высвобождения возбуждающих аминокислот из пресинаптических окончаний. Он полностью всасывается при энтеральном введении. Максимальная концентрация в крови создается через 2-2,5 ч. Действует ламотриджин длительно; t1/2 ~ 24-30 ч. Около 55% введенного препарата связывается с белками плазмы крови. До 65% вещества метаболизируется в печени. Образующиеся глюкурониды выводятся в основном почками. Следовательно, дозировать препарат следует с учетом функции печени и почек. Это необходимо иметь в виду при комбинированном применении ламотриджина с препаратами, влияющими на активность микросомальных ферментов печени. Назначается при малых приступах, психомоторной эпилепсии, а также при больших приступах эпилепсии. Из побочных эффектов возможны головокружение, атаксия, диплопия, тошнота, аллергические реакции и др.
Миоклонус-эпилепсия довольно устойчива к медикаментозному лечению. Обычно в этих случаях эффективны бензодиазепины клоназепам, диазепам (сибазон, седуксен), и нитразепам (эуноктин). Следует отметить, что клоназепам оказывает положительное влияние при многих формах эпилепсии, вызывая минимальные побочные эффекты (возможны сонливость, редко атаксия, нарушение аппетита и др.). Нитразепам применяют также при малых приступах эпилепсии. Противосудорожную активность бензодиазепинов связывают с их ГАМК-миметическим эффектом (см. главы 7 и 11.4).
При этой форме эпилепсии нередко используют натрия вальпроат (депакин), который оказался также активным при больших и малых припадках. Малоэффективен он при психомоторных припадках. Механизм его противосудорожного действия сложен. Он связан с накоплением в мозге ГАМК, так как натрия вальпроат тормозит ее биотрансформацию (ингибирует ГАМК-трансаминазу) и стимулирует ее синтез (активирует фермент глутаматдекарбоксилазу). Кроме того, он угнетает натриевые каналы и в небольшой степени блокирует кальциевые каналы Т-типа. Побочные эффекты (тошнота, атаксия, сонливость) наблюдаются относительно редко и выражены в небольшой степени.
Имеются данные, что натрия вальпроат может усиливать побочные эффекты других противоэпилептических средств. Это следует иметь в виду, так как натрия вальпроат нередко применяют в качестве одного из компонентов комбинированной терапии эпилепсии.
Противоэпилептическими свойствами обладают также вещества, входящие в другие фармакологические группы, например ингибиторы карбоангидразы диакарб, сультиам.
Отмену противоэпилептических препаратов следует производить постепенно, чтобы не развился феномен «отдачи», что может привести к возобновлению и усилению судорог.
Поиски новых эффективных противоэпилептических средств проводятся достаточно широко и в разных направлениях. По-прежнему большое внимание уделяется системе ГАМК. Созданы активные избирательные и необратимые ингибиторы ГАМК-трансаминазы, хорошо проникающие в мозг, вещества прямого ГАМКА-миметического действия. Исследуется противосудорожная активность различных блокаторов кальциевых каналов. Кроме того, ведутся интенсивные исследования препаратов нового типа действия среди антагонистов возбуждающих аминокислот. Одни полученные соединения проходят клинические испытания, другие находится в стадии доклинического изучения, поэтому оценить их перспективы для практической медицины пока затруднительно.
| Препараты | ||
| Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
| Дифенин — Dipheninum | Внутрь 0,117 г | Таблетки по 0,117 г |
| Гексамидин — Hexamidinum | Внутрь 0,125-0,5 г | Таблетки по 0,125 и 0,25 г |
| Карбамазепин — Carbamazepine | Внутрь 0,2-0,4 г | Таблетки по 0,2 г |
| Клоназепам — Clonazepame | Внутрь 0,001-0,002 г | Таблетки по 0,001 г |
| Натрия вальпроат — Natrii valproas | Внутрь 5-10 мг/кг | Таблетки по 0,15; 0,2; 0,3 и 0,5 г; капсулы по 0,15 и 0,3 г |
| Этосуксимид — Ethosuximidum | Внутрь 0,25 г (15 капель) | Капсулы по 0,25 г; флаконы по 50 мл раствора (содержат 2,5 г препарата) для приема внутрь |
| Ламотриджин — Lamotrigine | Внутрь 0,05-0,2 г | Таблетки по 0,05; 0,1 и 0,2 г |
| Триметин — Trimethinum | Внутрь 0,2-0,3 г | Порошок; таблетки по 0, 1 и 0,3 г |
Глава 10 ПРОТИВОПАРКИНСОНИЧЕСКИЕ СРЕДСТВА
Эту группу средств применяют для лечения болезни Паркинсона, а также при паркинсонизме различного происхождения.
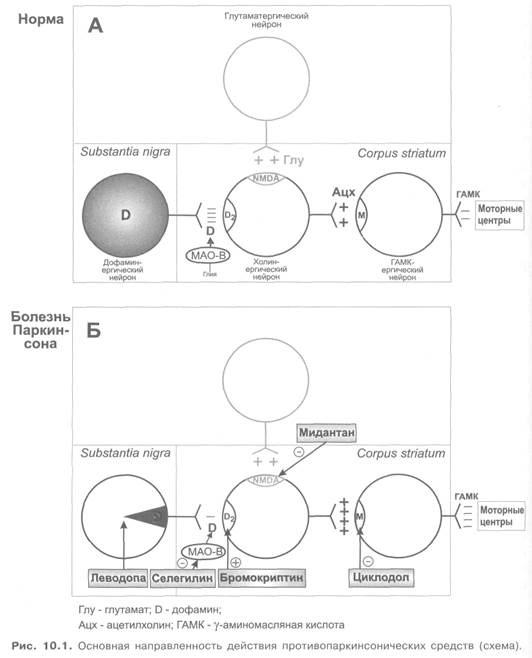
Болезнь Паркинсона представляет собой хроническое нейродегенеративное заболевание, при котором поражаются ядра экстрапирамидной системы. Наиболее частыми проявлениями этой патологии являются ригидность (резко повышенный тонус мышц), тремор (постоянное непроизвольное дрожание), гипокинезия (скованность движений). Изменяются также походка и поза больного. Постепенно возникают психические нарушения, страдает умственная деятельность. Этиология болезни Паркинсона неизвестна. Обнаружено, однако, что при этом заболевании в базальных ядрах, а также в черной субстанции снижается содержание дофамина, который оказывает преимущественно тормозное влияние на неостриатум. Последний, как известно, участвует в регуляции функций спинного мозга. По современным представлениям, недостаток дофамина является основной причиной двигательных и психических нарушений, которые характеризуют синдром паркинсонизма.
За последние годы показано, что в развитии болезни Паркинсона ведущую роль играет возникающий дисбаланс между дофаминергической и глутаматергической системами головного мозга. Как уже было отмечено, при развитии болезни Паркинсона в нейронах черной субстанции снижается содержание дофамина, оказывающего тормозное влияние на нейроны неостриатума. На этом фоне превалирует стимулирующее влияние глутаматергических нейронов. Это приводит к нарушению двигательной и психической функций. Возникают гипокинезия, тремор, ригидность и брадифрения. С учетом сказанного терапия болезни Паркинсона направлена на восстановление динамического равновесия между разными медиаторными системами, вовлеченными в регуляцию функций базальных ядер. Одна из основных задач фармакотерапии паркинсонизма — устранение дефицита дофамина в соответствующих ядрах. Воспользоваться для этой цели самим дофамином не представляется возможным, так как он практически не проникает через гематоэнцефалический барьер и, следовательно, не попадает при обычных путях введения в ткани мозга. Поэтому при паркинсонизме используют предшественник дофамина L-ДОФА, который проходит через тканевые барьеры и затем в нейронах под влиянием фермента ДОФА-декарбоксилазы превращается в дофамин. Повысить активность дофаминергической системы можно и за счет усиления выделения и(или) угнетения нейронального захвата дофамина нейронами черной субстанции. С этой же целью можно воспользоваться веществами, которые оказывают прямое стимулирующее влияние на дофаминовые рецепторы. Несомненный интерес представляют ингибиторы МАО-В, инактивирующей в тканях мозга дофамин.
Весьма перспективны также вещества, блокирующие глутаматергические влияния. К числу таких препаратов относятся антагонисты NMDA-рецепторов, устраняющие стимулирующие эффекты глутаматергических нейронов на базальные ядра и задерживающие дегенеративные изменения дофаминергических нейронов.
В функции ядер экстрапирамидной системы принимают участие также холинергические нейроны. При недостатке дофамина преобладают стимулирующие холинергические влияния. Для устранения создавшегося при этом дисбаланса между дофаминергическими и холинергическими влияниями можно использовать центральные холиноблокаторы. Препараты этой группы восстанавливают нарушенное равновесие за счет подавления холинергической передачи (рис. 10.1).
Исходя из принципов действия противопаркинсонических веществ, их подразделяют на следующие основные группы.
I. Вещества, активирующие дофаминергические влияния
1. Предшественник дофамина
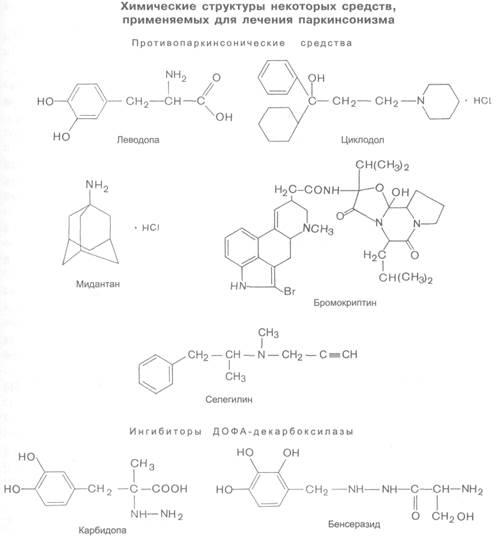
Леводопа
2. Средства, стимулирующие дофаминовые рецепторы (дофаминомиметики)
Бромокриптин
3. Ингибиторы моноаминоксидазы В
Селегилин
II. Вещества, угнетающие глутаматергические влияния
Мидантан
III. Вещества, угнетающие холинергические влияния
Циклодол
См. химические структуры
Леводопа (L-ДОФА, леводофа) представляет собой левовращающий изомер диоксифенилаланина, который является предшественником дофамина. Проникает через гематоэнцефалический барьер и затем в нейроны, где леводопа превращается в дофамин. Накапливаясь в базальных ганглиях, дофамин устраняет или ослабляет проявления паркинсонизма (см. рис. 10.1). Особенно выражение влияет леводопа на гипокинезию, менее — на ригидность, еще меньше — на тремор.
Леводопа относится к наиболее эффективным средствам, применяемым при лечении болезни Паркинсона и симптоматического паркинсонизма (исключая паркинсонизм, вызванный лекарственными препаратами, в частности антипсихотическими средствами). Действие леводопы развивается через 1 нед и более и достигает максимума примерно через 1 мес. Дозу увеличивают постепенно. Назначают препарат только после еды. Лечение проводят длительно, так как это по существу заместительная терапия (восполняется недостаток дофамина).
Из желудочно-кишечного тракта препарат всасывается быстро. Однако значительная его часть (~ 70%) метаболизируется в слизистой оболочке кишечника.
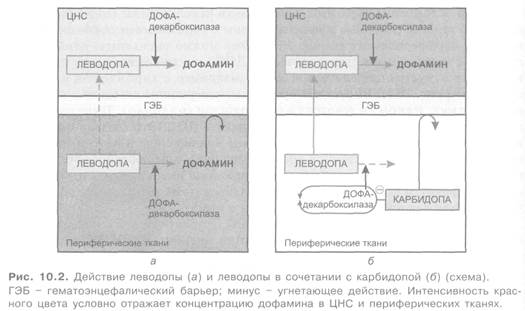
В организме превращается в дофамин и другие метаболиты. Это происходит под влиянием ДОФА-декарбоксилазы, КОМТ и МАО. В итоге в ЦНС поступает около 1% от введенной дозы леводопы. Метаболиты и незначительные количества неизмененной леводопы выделяются почками.
Довольно часто наблюдаются побочные эффекты: нарушение аппетита, тошнота, рвота, ортостатическая гипотензия, психические расстройства, двигательные нарушения (у ряда больных возникают хореиформные движения), сердечные аритмии.
Все эти осложнения обратимы и могут быть нивелированы снижением дозы леводопы. Многие побочные эффекты связаны с образованием дофамина из леводопы в периферических тканях. Последнее можно уменьшить, комбинируя леводопу с ингибиторами периферической ДОФА-декарбоксилазы, не проникающими через гематоэнцефалический барьер (например, с карбидопой или бенсеразидом; рис. 10.2). Выпускают препараты, содержащие леводопу с карбидопой (синемет, наком)и леводопу с бенсеразидом (мадопар). Такие сочетания повышают количество леводопы, поступающей в ЦНС. Это связано с тем, что ингибируется декарбоксилирование леводопы в кишечнике и печени (повышается ее поступление в системное кровообращение), в периферических тканях, например в почках (что способствует поддержанию высоких концентраций вещества в крови), а также в эндотелии капилляров мозга (устраняется энзиматический барьер для проникновения леводопы в мозг).
Для повышения эффективности леводопы, устранения или уменьшения ее побочных эффектов, помимо использования ингибиторов периферической
ДОФА-декарбоксилазы, применяют также ингибиторы КОМТ, например энтакапон (комтан). Кроме того, при тошноте и рвоте назначают блокаторы дофаминовых рецепторов периферических тканей и пусковой зоны рвотного центра (например, домперидон; не проникает через гематоэнцефалический барьер). При развитии психозов используют блокатор дофаминовых рецепторов головного мозга клозапин (в 10 раз активнее в отношении D4-, чем D2-рецепторов).
Нельзя сочетать леводопу с неизбирательными ингибиторами МАО (последняя инактивирует норадреналин, дофамин; при угнетении МАО может возникнуть резкая гипертензия), а также с пиридоксином (витамином В6), который снижает активность леводопы.
Наиболее эффективна леводопа в течение 2-5 лет. Постепенно развивается привыкание, возникают дискинезия и другие побочные эффекты.
Препарат противопоказан при тяжелых заболеваниях сердечно-сосудистой системы, печени, почек, при психозах.
К стимуляторам дофаминовых рецепторов, используемым при лечении паркинсонизма, относится бромокриптин (парлодел). По химическому строению это полусинтетическое производное алкалоида спорыньи эргокриптина (производное лизергиновой кислоты). Является агонистом дофаминовых D2-рецепторов. Обладает отчетливой противопаркинсонической активностью. К типичным эффектам бромокриптина относится также торможение продукции пролактина и гормона роста (см. главу 20; 20.1). Принимается внутрь. Из желудочно-кишечного тракта всасывается около 30%. Большая часть инактивируется при первом прохождении печеночного барьера. Максимальная концентрация в плазме накапливается через 1,5-3 ч; t1/2 =3-6 ч. Значительная часть бромокриптина подвергается биотрансформации. Основной путь выведения — с желчью в кишечник. Бромокриптин, как правило, применяют в комбинации с леводопой.
Побочные эффекты на начальных стадиях лечения: тошнота, рвота, ортостатическая гипотензия. При длительном применении возможны психические нарушения, дискинезия, непереносимость этилового спирта, запор и др.
Одним из агонистов D2- и D3-дофаминовых рецепторов является ропинирол (реквип). Противопаркинсонический эффект связывают с его влиянием на постсинаптические D2-дофаминовые рецепторы в неостриатуме. Угнетает секрецию пролактина. По эффективности при паркинсонизме ропинирол превосходит бромокриптин. Центральные эффекты его устраняются антипсихотическими и другими средствами, блокирующими дофаминовые D2-рецепторы.
Препарат является также агонистом периферических D2-рецепторов. Это может проявляться ортостатической гипотензией, что можно предупредить введением блокатора этих рецепторов — домперидона.
При введении внутрь ропинирол всасывается быстро и полностью. Максимальная концентрация в плазме крови определяется через 1 ч. Биодоступность около 55%. С белками плазмы крови связывается 10-40% вещества. Большая часть метаболизируется в печени. Выделяется почками (менее 10% в неизмененном виде). t1/2~ 6ч.
Используется при лечении паркинсонизма в виде монотерапии или в комбинации с леводопой. Вводится внутрь 3 раза в сутки. При прекращении применения препарата следует постепенно уменьшать его дозу (в течение недели).
Из побочных эффектов возможны сонливость, внезапное наступление сна, тошнота, отеки нижних конечностей, диспепсические явления, дискинезия и др.
Как отмечалось, один из путей усиления дофаминергических влияний заключается в подавлении процессов инактивации дофамина. По такому принципу действуют ингибиторы МАО-В. К избирательным необратимо действующим ингибиторам этого фермента относится селегилин (депренил). Обычно его применяют в сочетании с леводопой. Отличается от ингибиторов МАО неизбирательного действия тем, что при взаимодействии с симпатомиметиками не вызывает выраженных гипертензивных реакций (см. главу 11.2).
В эксперименте обнаружено, что, помимо ингибирования МАО-В, селегилин обладает нейропротекторным эффектом, уменьшая повреждение нейронов при ишемии и при воздействии ряда нейротоксических веществ. Частично это может быть связано с индукцией фактора роста нервов, продуцируемого глиальными астроцитами. Имеются предварительные клинические данные о благоприятном влиянии селегилина на состояние пациентов при таком нейродегенеративном заболевании, как болезнь Альцгеймера. Не исключено, что подобный эффект может проявляться и в отношении болезни Паркинсона, но это требует специального исследования.
К противопаркинсоническим веществам, угнетающим глутаматергические влияния, относится мидантан (амантадина гидрохлорид, симметрел). Согласно современным представлениям, мидантан блокирует глутаматные NMDA-рецепторы и тем самым снижает чрезмерное стимулирующее влияние кортикальных глутаматных нейронов на неостриатум, развивающееся на фоне недостаточности дофамина. Это уменьшает клинические проявления болезни Паркинсона — ригидность, тремор и гипокинезию. Кроме того, отмечено что мидантан обладает нейропротективным эффектом в отношении нейронов черной субстанции. Связывают это также с угнетением NMDA-рецепторов указанных нейронов и уменьшением поступления в клетки ионов кальция, что снижает возможность деструкции нейронов и замедляет прогрессирование заболевания. Мидантан обладает и некоторым м-холиноблокирующим эффектом.
Применяют мидантан при лечении болезни Паркинсона и симптоматическом паркинсонизме (постэнцефалитическом или цереброваскулярном), особенно в случаях, когда леводопа противопоказана. Мидантан устраняет или уменьшает гипокинезию, в меньшей степени — ригидность и тремор. Улучшение наступает через 1-2 сут и более; максимальный эффект наблюдается через несколько дней, иногда недель.
Переносится мидантан в большинстве случаев хорошо. Из побочных эффектов иногда наблюдаются бессонница, галлюцинации, ортостатическая гипотензия, диспепсические расстройства, головная боль.
Препарат следует с осторожностью применять при ряде заболеваний ЦНС, сопровождающихся галлюцинациями, эпилептиформными судорогами, а также при тяжелых заболеваниях печени и почек.
Весьма целесообразно комбинированное применение с леводопой, что позволяет уменьшить ее дозу.
Последняя группа противопаркинсонических средств представлена так называемыми центральными холиноблокаторами. Они подавляют стимулирующие холинергические влияния на базальные ганглии благодаря угнетению центральных холинорецепторов. На синтез, высвобождение и гидролиз ацетилхолина, по имеющимся данным, они не влияют. Из таких препаратов широкое применение получил циклодол (артан, тригексифенидила гидрохлорид). Он оказывает как центральное, так и периферическое м-холиноблокирующее действие. Влияние на ЦНС способствует уменьшению или устранению двигательных нарушений, связанных с поражением экстрапирамидной системы. Циклодол наиболее эффективно уменьшает тремор и в меньшей степени — ригидность, мало влияя на гипокинезию.
Применяют циклодол при болезни Паркинсона, паркинсонизме и других патологических состояниях, связанных с поражением экстрапирамидной системы. Циклодол эффективен также при явлениях паркинсонизма, вызванных антипсихотическими средствами. Назначают препарат внутрь. Он хорошо всасывается из тонкой кишки и быстро выводится. Кумуляции не наблюдается. При длительном применении развивается привыкание.
Угнетение периферических м-холинорецепторов является причиной ряда эффектов (сухость слизистой оболочки полости рта, тахикардия, нарушение аккомодации, снижение тонуса мышц кишечника и др.). Спазмолитическое действие циклодола связано как с атропиноподобным, так и с прямым миотропным (папавериноподобным) действием. При передозировке циклодола могут возникать нарушения со стороны ЦНС (возбуждение, галлюцинации).
Циклодол противопоказан или его следует применять с осторожностью при глаукоме, нарушении мочеотделения, вызванном гипертрофией предстательной железы, при заболеваниях сердца, печени, почек. Не следует назначать циклодол пожилым людям (ухудшается память, нарушается мышление).
При лечении паркинсонизма иногда используют и другие центральные холиноблокаторы: тропацин (дифенилтропина гидрохлорид), бензтропина мезилат (когентин) и др.
Все перечисленные противопаркинсонические препараты не относятся к средствам этиотропной терапии. Они лишь устраняют или ослабляют синдром паркинсонизма, и поэтому лечебный эффект сохраняется только во время их применения.
| Препараты | ||
| Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
| Леводопа — Levodopa | Внутрь 0,25-1 г | Капсулы и таблетки по 0,25-0,5 г |
| Мидантан — Midantanum | Внутрь 0,05-0,1 г | Таблетки, покрытые оболочкой, по 0,1 г |
| Циклодол — Cyclodolum | Внутрь 0,001-0,005 г | Таблетки по 0,001; 0,002 и 0,005 г |
| Селегилин — Selegiline | Внутрь 0,005-0,01 г | Таблетки по 0,005 и 0,01 г |
| Бромокриптин — Вrоmоcriptine | Внутрь 0,03-0,04 г | Таблетки по 0,0025 г; капсулы по 0,005 и 0,01 г |
Глава 11 ПСИХОТРОПНЫЕ СРЕДСТВА
Препараты этой группы применяют при нарушениях психической деятельности. Их используют при лечении психозов, а также при невротических и неврозо-подобных расстройствах, сопровождающихся состоянием напряжения, беспокойства, страха, тревоги и другими симптомами.
Механизмы действия психотропных веществ изучены лишь в небольшой степени, хотя масштабы таких исследований велики. Наиболее интересны сведения о влиянии этих веществ на межнейронную передачу, обмен биогенных аминов, на холинергические системы головного мозга, взаимодействие с пептидами, аминокислотами, оказывающими стимулирующее и тормозное влияние на нейроны, и др. Однако механизмы антипсихотического и антиневротического действия препаратов остаются недостаточно ясными, и прежде всего потому, что причины возникновения многих психических заболеваний и психопатологических состояний не установлены. Значительные трудности возникают при поиске и доклинической оценке потенциальных психотропных препаратов. К сожалению, не существует адекватных экспериментальных моделей психических расстройств, наблюдаемых у человека. В связи с этим приходится использовать комплекс разнообразных методик, позволяющих оценить влияние вещества на высшую нервную деятельность животных и на этом основании прогнозировать возможности их клинического применения. При исследовании психотропного действия веществ широко используют разнообразные варианты метода условных рефлексов, изучают их влияние на поведенческие реакции, эмоции, мотивации, двигательную активность, экспериментальные психозы и неврозы. Благодаря накопленному опыту в области психофармакологии можно, хотя и в общих чертах, предсказать сферу предполагаемого применения нового соединения, основываясь на некоторых имеющихся корреляциях между экспериментальными и клиническими данными. Однако решающее суждение о пригодности препарата для лечения или профилактики определенных психопатологических состояний можно высказать только после клинических исследований.
Широкое внедрение в медицинскую практику психотропных средств началось с середины XX в. За прошедший период появилось множество препаратов, эффективных при различных психических расстройствах (табл. 11.1). Так, при психозах с успехом используют антипсихотические средства (аминазин, галоперидол и др.), антидепрессанты (имизин, ниаламид), соли лития. Для большинства антипсихотических средств, помимо специфического антипсихотического эффекта, характерно успокаивающее (седативное) действие. Основным свойством антидепрессантов является их способность устранять депрессии. Кроме того, антидепрессанты из группы неизбирательных ингибиторов МАО (ниаламид) обладают психостимулирующим эффектом. У трициклических антидепрессантов (например, у имизина) наряду с антидепрессивной активностью может проявляться как психостимулирующее, так и седативное действие. Соли лития применяют для лечения и профилактики маниакальных состояний; ни стимулирующего, ни седативного действия на психическую сферу здорового человека они не оказывают.
| Таблица 11.1 Психотропные средства | |||
| Группа | Средства, применяемые преимущественно при психозах | Средства, применяемые преимущественно при психических нарушениях непсихотического характера (или так называемых пограничных состояниях) | |
| Вещества с психоседативным действием | Антипсихотические средства | Анксиолитики Седативные средства | |
| Антидепрессанты | |||
| Вещества с психостимулирующим действием | Психостимуляторы | ||
| Вещества, не оказывающие на здоровых людей ни психоседативного, ни психостимулирующего действия | Средства для лечения маний (соли лития) |
При психических расстройствах непсихотического (невротического) характера назначают анксиолитики (диазепам и др.), седативные средства (бромиды, препараты валерианы) и психостимуляторы (пиридрол). К психотропным веществам относятся и так называемые галлюциногены, или психотомиметики (ЛСД-25, мескалин и др.). Эти вещества вызывают кратковременные остро развивающиеся психозы. Лечебного значения галлюциногены не имеют, однако в социальном аспекте они требуют внимания, так как относятся к средствам, приводящим к развитию психической зависимости. Для теоретической медицины они представляют некоторый интерес в качестве веществ, вызывающих экспериментальные психозы.
Открытие и внедрение в практику активных психотропных средств является одним из наиболее крупных достижений медицины. Прежде всего это принципиально изменило ситуацию в терапии психических заболеваний. До появления этих препаратов возможности лечения такого контингента больных были более чем ограниченны (в основном использовали электрошок и инсулиновую кому). Кроме того, психотропные препараты существенно пополнили арсенал лекарственных средств, применяемых в других областях медицины, — терапии, анестезиологии, неврологии и др. Важно и то, что успехи в создании психотропных средств в значительной степени стимулировали фундаментальные исследования (фармакологические, физиологические, биохимические, патофизиологические) по столь важной и вместе с тем сложной для познания проблеме, как механизмы разных проявлений деятельности головного мозга, а также в выяснении этиологии и патогенеза психических нарушений и принципов их лечения.
11.1. АНТИПСИХОТИЧЕСКИЕ СРЕДСТВА (НЕЙРОЛЕПТИКИ)
Препараты этой группы оказывают антипсихотическое и в той или иной степени выраженное седативное (успокаивающее) действие. Антипсихотический эффект проявляется в устранении продуктивной симптоматики психозов (бреда, галлюцинаций) и задержке дальнейшего развития заболевания. Седативное действие характеризуется общим успокоением — устранением аффективных реакций, снижением беспокойства, тревоги, понижением двигательной активности.
Механизм антипсихотического действия недостаточно выяснен. Высказывается предположение, что для большинства препаратов данной группы этот эффект связан с блоком постсинаптических дофаминовых D2-рецепторов лимбической системы. Блокирующее влияние на дофаминовые рецепторы проявляется антагонизмом с дофамином и дофаминомиметиками (апоморфином, фенамином) как по поведенческим реакциям, так и на уровне отдельных нейронов.
Влиянием на дофаминергическую систему объясняется также способность антипсихотических средств вызывать столь типичный для них побочный эффект, как экстрапирамидные нарушения. В этом случае все события разыгрываются в неостриатуме, где локализуется значительное число рецепторов, чувствительных к дофамину, которые блокируют антипсихотические средства.
Антагонизм между антипсихотическими средствами и дофамином подтверждается, в частности, экспериментами с ионофоретической инъекцией дофамина в область хвостатого ядра. Предварительное введение в этих условиях опыта антипсихотического средства аминазина устраняет угнетающее влияние дофамина на нейроны хвостатого ядра. Благодаря подавлению нигростриарной передачи и снижению тормозной функции черной субстанции в отношении неостриатума (см. рис. 10.1) изменяется участие последнего в регуляции двигательной активности. Проявляется это усилением активности α-мотонейронов спинного мозга, повышением тонуса мышц и развитием лекарственного паркинсонизма (возникают гипокинезия, ригидность, тремор). Предполагается, что изменение функционального состояния неостриатума может иметь значение и в развитии антипсихотического действия нейролептиков.
С блокадой дофаминовых рецепторов связан также ряд других эффектов антипсихотических средств (табл. 11.2).
| Таблица 11.2 Некоторые эффекты, связанные с блокирующим действием антипсихотических средств на дофаминовые рецепторы головного мозга | |
| Локализация дофаминовых рецепторов | Основные эффекты |
| Мезолимбическая и мезокортикальная системы | Антипсихотический эффект. Эмоциональная индифферентность. Депрессия |
| Гипоталамус— гипофиз | Снижение температуры тела. Галакторея (повышается выделение пролактина) |
| Экстрапирамидная система | Явления паркинсонизма; поздняя дискинезия |
| Пусковая («триггер») зона рвотного центра | Противорвотный эффект |
 Седативное действие антипсихотических средств, по-видимому, частично связано с их влиянием на восходящую ретикулярную формацию ствола головного мозга. Антипсихотические средства устраняют реакцию активации ЭЭГ на внешние раздражения, мало влияя на возбудимость нейронов ретикулярной формации при их прямом электрическом раздражении. Показано, что при ионофоретическом нанесении ряда антипсихотических средств на нейроны ретикулярной формации ствола головного мозга уменьшается или утрачивается их чувствительность к возбуждающему действию норадреналина. Очевидно, блокируя адренорецепторы, антипсихотические средства угнетают передачу нервных импульсов с коллатералей специфических афферентных путей на нейроны ретикулярной формации. По-видимому, в седативном эффекте важную роль играет также их влияние на лимбическую систему и гипоталамус.
Седативное действие антипсихотических средств, по-видимому, частично связано с их влиянием на восходящую ретикулярную формацию ствола головного мозга. Антипсихотические средства устраняют реакцию активации ЭЭГ на внешние раздражения, мало влияя на возбудимость нейронов ретикулярной формации при их прямом электрическом раздражении. Показано, что при ионофоретическом нанесении ряда антипсихотических средств на нейроны ретикулярной формации ствола головного мозга уменьшается или утрачивается их чувствительность к возбуждающему действию норадреналина. Очевидно, блокируя адренорецепторы, антипсихотические средства угнетают передачу нервных импульсов с коллатералей специфических афферентных путей на нейроны ретикулярной формации. По-видимому, в седативном эффекте важную роль играет также их влияние на лимбическую систему и гипоталамус.
На ЭЭГ седативное действие антипсихотических средств проявляется возникновением высоковольтных медленных колебаний (результат синхронизации ЭЭГ).
Помимо блокирования рецепторов, чувствительных к дофамину и норадреналину, антипсихотические средства, по-видимому, в какой-то степени нарушают высвобождение этих биогенных аминов и их обратный нейрональный захват.
Для некоторых антипсихотических средств (например, производных фенотиазина) в развитии психотропных эффектов может иметь значение их блокирующее влияние на серотониновые рецепторы и м-холинорецепторы головного мозга.
Антипсихотические препараты принято подразделять на так называемые «типичные» и «атипичные». Основное различие заключается в том, что для «типичных» препаратов характерен такой побочный эффект, как нарушение функции экстрапирамидной системы (возникают паркинсонизм и другие двигательные нарушения). Для «атипичных» антипсихотических средств этот крайне отрицательный эффект наблюдается относительно редко и выражен в небольшой степени. Основой этих различий является несколько иной спектр рецепторного действия, в частности, в отношении разных подтипов дофаминовых рецепторов. К указанным группам относятся следующие препараты.
А. «Типичные» антипсихотические средства
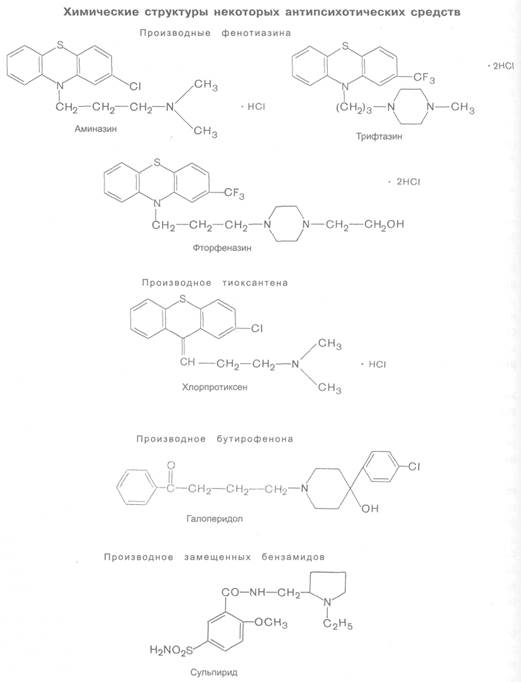
Производные фенотиазина
Аминазин
Трифтазин
Фторфеназин
Производные тиоксантена
Хлорпротиксен
Производные бутирофенона
Галоперидол
Б. «Атипичные» антипсихотические средства
Бензамиды
Сульпирид
Производные бензодиазепина
Клозапин
Наибольшее количество препаратов относится к фенотиазиновым производным, которые в зависимости от радикалов у N10 подразделяют на ряд подгрупп:
- Алифатические производные (аминазин).
- Пиперазиновые производные (трифтазин, фторфеназин).
- Пиперидиновые производные (тиоридазин).
«Типичным» представителем производных фенотиазина является аминазин (хлорпромазина гидрохлорид, ларгактил).
Аминазин имеет широкий спектр действия. Препарат оказывает выраженное влияние на ЦНС, а также на периферическую иннервацию, исполнительные органы и обмен веществ.
Влияние на ЦНС проявляется рядом эффектов. Так, для аминазина характерны антипсихотическое и седативное действие, а также способность вызывать экстрапирамидные расстройства (при длительном применении). В больших дозах он вызывает гипнотический эффект: наступает поверхностный сон, легко прерываемый внешним раздражением.
Типичным для аминазина является миорелаксирующее действие — снижение двигательной активности. Связано это с угнетением супраспинальной регуляции мышечного тонуса в основном за счет воздействия на базальные ядра. Аминазин также уменьшает или полностью устраняет нисходящие облегчающие влияния ретикулярной формации на спинальные рефлексы. Непосредственно на спинной мозг препарат не действует.
Аминазин угнетает центр теплорегуляции. Конечный эффект зависит от температуры окружающей среды. Чаще всего наблюдается незначительная гипотермия (за счет увеличения теплоотдачи). В то же время при сочетании аминазина с физическим охлаждением возникает выраженное снижение температуры тела.
Аминазин обладает отчетливым противорвотным эффектом, который связан с блокированием дофаминовых рецепторов пусковой зоны (trigger zone), расположенной на дне IV желудочка. Благодаря этому аминазин предупреждает рвоту, вызываемую апоморфином, морфином, противобластомными средствами из группы хлорэтиламинов (см. главу 32; 32.1).
Одним из проявлений влияния аминазина на ЦНС является его способность потенцировать действие ряда нейротропных препаратов — средств для наркоза, снотворных наркотического типа, опиоидных анальгетиков. Усиление их эффектов частично связано с угнетением аминазином процессов биотрансформации этих препаратов.
Аминазин оказывает влияние и на периферическую иннервацию. Наиболее выражено у него α-адреноблокирующее действие. Так, на фоне аминазина прессорная реакция на адреналин резко снижается или наступает «извращение» эффекта адреналина и артериальное давление падает (см. главу 4; 4.2). Кроме того, аминазину присущи некоторые м-холиноблокирующие (атропиноподобные) свойства. Это проявляется небольшим снижением секреции слюнных, бронхиальных и пищеварительных желез. Передачу возбуждения в вегетативных ганглиях он не нарушает.
Аминазин влияет не только на эфферентную, но и на афферентную иннервацию. При местном действии он вызывает выраженное раздражение, которое сменяется анестезией. У аминазина имеется отчетливая противогистаминная активность (блокирует гистаминовые Н1-рецепторы; см. главу 25). Он является также спазмолитиком миотропного действия.
Для аминазина характерно влияние на сердечно-сосудистую систему, заключающееся в более или менее выраженном снижении артериального давления. Механизм гипотензии довольно сложен. Он связан с угнетением центров гипоталамуса, с α-адреноблокирующими и спазмолитическими свойствами аминазина, подавлением компенсаторных сосудосуживающих рефлексов, а также со снижением силы сердечных сокращений. Гипотензии обычно сопутствует рефлекторная тахикардия.
Вводят аминазин энтерально и парентерально. Длительность его терапевтического эффекта при однократном введении составляет приблизительно 6 ч. Из желудочно-кишечного тракта препарат всасывается не полностью. Метаболизируется при первом прохождении через печеночный барьер. Поэтому при указанном пути введения биодоступность аминазина составляет примерно 30%. При инъекции в вену аминазин (с учетом его раздражающего действия) вводят медленно. В организме значительная его часть подвергается биотрансформации. Аминазин и разнообразные продукты его превращения выводятся почками и кишечником. Экскреция их происходит медленно (в течение многих дней).
При длительном применении аминазина развивается привыкание к нему. Однако это касается лишь седативного, гипотензивного и ряда других эффектов; антипсихотическое действие при этом не изменяется.
Большой интерес представляют соединения, у которых в боковой цепочке, связанной с атомом азота фенотиазина, имеется пиперазиновый цикл. Эта группа включает метеразин, этаперазин, трифтазин, фторфеназин и др.
Трифтазин (трифлуоперазина гидрохлорид, стелазин) характеризуется более избирательным, чем аминазин, антипсихотическим влиянием и менее выраженным седативным эффектом. По противорвотной активности он превосходит аминазин. Отличается от последнего более слабым гипотензивным, адреноблокирующим и миорелаксирующим действием. Чаще возникают экстрапирамидные расстройства.
Фторфеназин (флуфеназина гидрохлорид, модитен) по эффективности в качестве антипсихотического средства аналогичен трифтазину. Как противорвотное средство несколько превосходит его. Используется пролонгированный препарат фторфеназина деканоат (модитен-депо, флуфеназина деканоат), действие которого продолжается 7-14 дней и более.
Препараты фенотиазинового ряда могут вызывать разнообразные побочные эффекты. Это могут быть общая вялость, апатия, сонливость, сухость в полости рта, дискомфорт в области сердца, подложечной области; возможны гипотензия, ортостатический коллапс (перечисленное чаще наблюдается при использовании аминазина). Иногда развивается застойная желтуха (обычно при применении аминазина). Для антипсихотических средств фенотиазинового ряда (особенно для препаратов, содержащих пиперазиновый цикл) характерны экстрапирамидные расстройства (паркинсонизм и др.). При длительном применении фенотиазиновых антипсихотических средств (в течение многих месяцев и лет) возможно развитие так называемой поздней дискинезии. Она характеризуется непроизвольными хореоатетоидными сокращениями мышц лица, языка, а также мышц конечностей и тела. Чаще возникает у пожилых пациентов. Медикаментозное лечение поздней дискинезии малоэффективно. Обычно в таких случаях отменяют антипсихотическое средство или уменьшают его дозу. Прекращают прием средств с холиноблокирующей активностью (антидепрессантов, противопаркинсонических препаратов), если таковые комбинировались с антипсихотическими средствами. Иногда прибегают к назначению диазепама.
В редких случаях развивается так называемый злокачественный нейролептический синдром. Считается, что он является результатом идиосинкразии к назначенному препарату. Возникает мышечная ригидность, резко повышается температура тела, страдает функция сердечно-сосудистой системы, нарушается сознание и т.д. 10—20% таких больных погибают. Для лечения этого осложнения используют диазепам, бромокриптин, дантролен. При лихорадке проводится также наружное физическое охлаждение тела.
Нередко наблюдаются диспепсические нарушения — потеря аппетита, тошнота. Фенотиазины вызывают раздражение кожи и слизистых оболочек. Раздражающее действие может возникать на путях введения препаратов (в вену, мышцу, энтерально). Возможны дерматиты, включая фотосенсибилизацию кожи. Тяжелыми осложнениями являются лейкопения и агранулоцитоз (развиваются редко).
К производным тиоксантена относится хлорпротиксен (труксал). По химическому строению он схож с аминазином. Отличается от производных фенотиазина тем, что в тиоксантеновом гетероцикле на месте азота находится атом углерода с двойной связью (см. структуру). По выраженности антипсихотического действия хлорпротиксен уступает фенотиазиновым производным. Препарат интересен тем, что обладает также некоторой антидепрессивной активностью. Вызывает выраженный седативный эффект, имеет противорвотные свойства, усиливает действие средств для наркоза, снотворных наркотического типа и опиоидных анальгетиков. В небольшой степени угнетает α-адренорецепторы.
Побочные эффекты хлорпротиксена аналогичны наблюдаемым при применении аминазина, однако он значительно реже вызывает фотосенсибилизацию и пигментацию кожи.
Большой интерес в качестве антипсихотических средств представляют производные бутирофенона.
Из этого ряда соединений для лечения психических заболеваний в основном применяют галоперидол (галофен). Действие его наступает относительно быстро и продолжается длительное время. При введении внутрь максимальная концентрация в плазме крови отмечается через 2-6 ч и сохраняется на высоком уровне около 3 сут. Через 5 сут почками выделяется около 40% введенного вещества.
Высокая антипсихотическая активность галоперидола сочетается с умеренным седативным эффектом. Механизм психотропного действия галоперидола связывают с блокадой дофаминовых рецепторов, центральным α-адреноблокирующим действием, а также нарушением нейронального захвата и депонирования норадреналина.
Галоперидол в небольших дозах блокирует дофаминовые D2-рецепторы пусковой зоны рвотного центра. Потенцирует действие средств для наркоза, снотворных наркотического типа и опиоидных анальгетиков. В отличие от фенотиазинов галоперидол не укорачивает фазу «быстрого» сна. У галоперидола в терапевтических дозах отсутствуют ганглиоблокирующие и атропиноподобные свойства; он незначительно угнетает периферические α-адренорецепторы. Артериальное давление обычно не снижает, ортостатической гипотензии не вызывает.
Из побочных эффектов галоперидола наиболее часты нарушения со стороны экстрапирамидной системы. Могут быть кожные реакции. Редко возникает лейкопения. При передозировке появляются тревога, страх, бессонница.
Производным бутирофенона является также препарат дроперидол. Он отличается от галоперидола кратковременным действием. Применяют дроперидол главным образом для нейролептанальгезии (в сочетании с обезболивающим средством фентанилом; см. главу 8).
К производным замещенных бензамидов относится сульпирид. Он является избирательно действующим блокатором дофаминовых D2-рецепторов. Обладает д
Date: 2015-07-01; view: 2070; Нарушение авторских прав