
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Адреноблокирующие средства 3 page
|
|
Важной группой медиаторов/модуляторов являются пептиды. К настоящему времени из тканей организма выделено более 40 пептидов, функции которых широко изучаются. Образуются биологически активные нейропептиды из предшественников, которые находятся в телах нейронов, где происходит их протеолиз. Активные метаболиты путем аксонального транспорта поступают к окончаниям нейронов, где и функционируют в качестве нейромедиаторов, ко-медиаторов или нейромодуляторов.
Каждый из пептидов взаимодействует со специфическими рецепторами, которые могут иметь довольно широкую локализацию (в центральной и периферической нервной системе, в тканях периферических органов). Ряд пептидов одновременно выполняет роль и гормонов, и нейромедиаторов (например, окситоцин). Наиболее детально изучена группа опиоидных пептидов — лейэнкефалин, метэнкефалин, β-эндорфин, динорфины, эндоморфины. Показано, что они специфически взаимодействуют с разными подтипами опиоидных рецепторов (μ-, δ-,κ-рецепторами). Взаимодействие агонистов с каждым подтипом опиоидных рецепторов сопровождается определенными эффектами (см. главу 8; 8.1). Известно, что к числу опиоидов экзогенного происхождения относятся опиоидные анальгетики. Синтезированы и антагонисты опиоидных рецепторов (например, налоксон).
Предположено, что кандидатами на роль нейромодуляторов могут быть пурины — пуриновые нуклеотиды (АДФ, АМФ) и аденозин. Как уже отмечалось, имеются специальные пуриновые рецепторы (пост- и пресинаптические), которые подразделяют на P1-рецепторы (более чувствительны к аденозину, чем к АТФ) и Р2-рецепторы (более чувствительны к АТФ). Р1-рецепторы подразделяют на аденозиновые A1- и А2-рецепторы. Пурины оказывают на нейроны ЦНС в основном угнетающее действие. Антагонисты P1-рецепторов — метилксантины (кофеин, теофиллин и др.) — стимулируют ЦНС.
Обсуждается вопрос об участии гистамина в межнейронной передаче возбуждения. В ЦНС обнаружены гистаминовые H1-, H2- и Н3-рецепторы. Гистамин при ионофоретическом подведении к нейронам мозга может вызывать как возбуждающий, так и тормозной эффекты. О гистаминовых H1- и Н2-рецепторах см. в главах 15.3 и 25.1.
Н3-рецепторы первоначально были обнаружены на гистаминергических нейронах ЦНС в виде пресинаптических рецепторов. Последние регулируют образование и высвобождение гистамина. Гистаминсодержащие нейроны в основном локализуются в заднем гипоталамусе (в туберомамиллярном ядре) и проецируются к разным областям ЦНС (коре больших полушарий, стриатуму, гиппокампу и др.). Помимо угнетающего влияния на высвобождение гистамина (роль ауторецепторов), пресинаптические Н3-рецепторы участвуют в регуляции продукции и ряда других медиаторов/модуляторов (ацетилхолина, ГАМК, дофамина, глутамата, серотонина, норадреналина), т.е. функционируют и как пресинаптические гетерорецепторы. Распределение гистаминсодержащих нейронов и гистаминовых рецепторов в ЦНС свидетельствует об участии гистамина в регуляции многих функций ЦНС. Так, гистамин, несомненно, является одним из компонентов регуляции цикла сон—бодрствование. В частности, в этом процессе принимают участие H1-рецепторы. Известно, что блокаторы этого подтипа рецепторов, проникающие в ЦНС, оказывают седативное действие (димедрол, дипразин). Показано, что в эксперименте некоторые агонисты Н3-рецепторов удлиняют «медленный» сон.
Отмечено также, что гистаминергическая система принимает участие в регуляции таких процессов, как обучение, запоминание. Показано, например, что антагонисты Н3-рецепторов могут улучшать мыслительные функции.
Следует также отметить важную роль гистамина в развитии эпилептических судорог. При определенных экспериментальных моделях судорог антагонисты H1-рецепторов и агонисты Н3-рецепторов оказывали противоэпилептическое действие. Кроме того, противогистаминные средства могут оказаться полезными при лечении ожирения.
Помимо ЦНС, гистаминовые Н3-рецепторы находятся также в желудочно-кишечном тракте (их стимуляция угнетает секрецию хлористоводородной кислоты желудка; они участвуют в гастропротекторном действии), в сердечно-сосудистой системе (активация пресинаптических гистаминовых Н3-рецепторов подавляет адренергические влияния), в верхних дыхательных путях (противовоспалительный эффект).
Возможности фармакотерапевтического использования агонистов и антагонистов Н3-рецепторов периферической локализации пока неясны.
Созданы агонисты [иммепип, иметит, (R)-α-метилгистамин] и антагонисты (ципроксифан, клобенпропит, тиоперамид, клозапин) Н3-рецепторов и начаты их клинические исследования.
Большое внимание привлекает также окись азота (NO). В нейронах гиппокампа и других отделах мозга обнаружена NO-синтетаза, которая участвует в биосинтезе NO. Очевидно, и в ЦНС окись азота выполняет роль медиатора. Однако ее функциональная значимость и возможности воздействия на эту систему с помощью фармакологических веществ изучены недостаточно.
В регуляции ряда функций ЦНС принимают участие и простагландины (например, в теплорегуляции, ноцицепции), что следует учитывать при создании лекарственных средств и изучении механизма их действия. Так, болеутоляющий и жаропонижающий эффекты неопиоидного анальгетика парацетамола объясняются его способностью ингибировать биосинтез простагландинов в ЦНС.
Из приведенных данных очевидно, что в центральной регуляции принимает участие множество нейромедиаторов и нейромодуляторов, взаимодействие которых и определяет функциональное состояние ЦНС. Эти нейромедиаторные системы являются важнейшей «мишенью» для воздействия фармакологических веществ.
Вместе с тем некоторые вещества действуют непосредственно на ионные каналы, без участия рецепторов (ряд противоэпилептических средств, блокаторы кальциевых каналов).
Некоторые неиротропные средства оказывают нормализующее влияние на энергетический обмен нейронов (например, ноотропные препараты).
Для более полного представления о механизмах возникновения тех или иных эффектов необходимо располагать многими данными. Так, требуется определить центры или ассоциации нейронов, наиболее чувствительные к данному препарату, т.е. основную локализацию его действия. Следует также установить этапы синаптической передачи, которые изменяются наиболее существенно, и определить биологический субстрат, являющийся «мишенью» для фармакологического средства. Наконец, важно выяснить, каковы механизмы взаимодействия препарата с рецепторами, с эндогенными физиологически активными веществами и т.д.
Разрешение всех этих вопросов лимитируется ограниченностью сведений о физиологии и патологии ЦНС. Недостаточно изучено взаимоотношение различных функциональных систем. Нет исчерпывающих данных о медиаторах и модуляторах, участвующих в межнейронной передаче в ЦНС, их взаимодействии и о рецепторах, с которыми они реагируют. Отсутствуют адекватные экспериментальные модели для большинства патологических состояний ЦНС. Тем не менее значительный объем фармакологических исследований в ряде случаев позволяет, хотя и в общих чертах, представить механизмы возникновения тех конечных эффектов, которые отражают фармакодинамику нейротропных средств и позволяют более целенаправленно использовать неиротропные препараты в медицинской практике.
Глава 5
СРЕДСТВА ДЛЯ НАРКОЗА (ОБЩИЕ АНЕСТЕТИКИ)
Вещества этой группы вызывают хирургический наркоз. Это состояние характеризуется обратимым угнетением ЦНС, которое проявляется выключением сознания, подавлением чувствительности (в первую очередь болевой) и рефлекторных реакций, снижением тонуса скелетных мышц. Такое определение, принятое в анестезиологии, включает лишь внешние признаки наркоза, который рассматривается применительно к целостному организму.
Все основные проявления действия средств для наркоза связаны с тем, что они угнетают межнейронную (синаптическую) передачу возбуждения в ЦНС. При этом нарушается передача афферентных импульсов, изменяются корковоподкорковые взаимоотношения, функция промежуточного мозга, среднего мозга, спинного мозга и т.д. Возникающая функциональная дезинтеграция ЦНС, связанная с нарушением синаптической передачи, и обусловливает развитие наркоза.
Отсутствие избирательности в действии средств для наркоза и большая вариабельность в их химическом строении первоначально дали основание полагать, что они оказывают однотипное угнетающее влияние на различные нейроны. Было высказано предположение, что происходит неспецифическое физико-химическое связывание их с мембранами нейронов (за исключением мембраны аксонов, на которую в наркотических концентрациях они, по-видимому, не действуют) за счет взаимодействия с липидами и(или) белками, а также, возможно, с молекулами воды, покрывающими мембраны. Это проводит к нарушению функции мембраны и, возможно, к обратимым изменениям ее ультраструктуры. Одним из проявлений взаимодействия средств для наркоза с постсинаптической нейрональной мембраной служит изменение проницаемости ионных каналов (например, для ионов калия), что нарушает процесс деполяризации и, следовательно, межнейронную передачу импульсов.
На основе изучения взаимодействия средств для наркоза с нейрональными мембранами и их компонентами (липидами, белками, водой) были предложены биофизические теории наркоза (адсорбционная теория, теория клеточной проницаемости, липидная и белковая теории, теория гидратированных микрокристаллов и др.). Однако все они не являются универсальными, так как касаются только ограниченного ряда соединений. Кроме того, указанные теории основываются обычно на модельных опытах, что не позволяет перенести полученные закономерности на условия целостного организма.
 Были предложены и биохимические теории, объясняющие наркоз способностью средств для наркоза угнетать обменные процессы нейронов ЦНС. Действительно, ряд препаратов снижает потребление мозговой тканью кислорода (например, тиопентал-натрий). Однако это свойство не является общим для всех средств для наркоза. Кроме того, изменения в биохимизме нейронов могут быть истолкованы как следствие наркоза, а не его причина.
Были предложены и биохимические теории, объясняющие наркоз способностью средств для наркоза угнетать обменные процессы нейронов ЦНС. Действительно, ряд препаратов снижает потребление мозговой тканью кислорода (например, тиопентал-натрий). Однако это свойство не является общим для всех средств для наркоза. Кроме того, изменения в биохимизме нейронов могут быть истолкованы как следствие наркоза, а не его причина.
Однако в последние годы появляется все больше данных, свидетельствующих о наличии рецепторного компонента в действии средств для наркоза. Так, в экспериментах показано, что практически все ингаляционные (летучие жидкости) и неингаляционные средства для наркоза (за исключением кетамина) в наркотических концентрациях взаимодействуют с ГАМКA-бензодиазепин-барбитуратовым рецепторным комплексом и потенцируют действие ГАМК. При этом увеличивается время активированного состояния хлорного ионофора, связанного с этим рецепторным комплексом. Закись азота на ГАМКА-рецепторы не влияет. Как уже отмечалось, установлено, что кетамин является антагонистом определенного типа глутаматных рецепторов (так называемых NMDA-рецепторов).
Не следует полностью исключать возможность его действия на другие типы рецепторов. В качестве аргумента можно воспользоваться данными о разнонаправленном действии эфира и метоксифлурана на стимулирующие эффекты ацетилхолина и L-глутамата в отношении нейронов обонятельной коры.
Синаптические образования разных уровней ЦНС и различной морфофункциональной организации обладают неодинаковой чувствительностью к средствам для наркоза. Этим объясняется наличие определенных стадий в действии средств для наркоза.
Выделяют следующие стадии:
I. — стадия анальгезии;
II. — стадия возбуждения;
III. — стадия хирургического наркоза;
1-й уровень (III1) — поверхностный наркоз,
2-й уровень (III2) — легкий наркоз,
3-й уровень (III3) — глубокий наркоз,
4-й уровень (III4) — сверхглубокий наркоз;
IV. — агональная стадия.
Приведенная последовательность стадий наркоза справедлива лишь в качестве общей схемы, так как стадия возбуждения при применении ряда препаратов может практически отсутствовать, варьирует выраженность стадии анальгезии и т.д. Более подробное описание отдельных стадий наркоза дано применительно к эфиру.
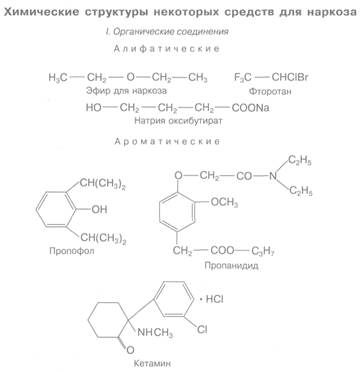
Средства для наркоза относятся к различным классам химических соединений (см. структуры). Выявить общие закономерности между их химическим строением и наркотической активностью не удалось. Установлены лишь частные зависимости для отдельных рядов соединений (углеводородов, барбитуратов).
С точки зрения практического применения средства для наркоза подразделяют на следующие группы.
I. Средства для ингаляционного наркоза
Жидкие летучие вещества
Фторотан
Энфлуран
Изофлуран
Эфир для наркоза
Газообразные вещества
Азота закись
II. Средства для неингаляционного наркоза
Пропанидид
Гексенал
Пропофол
Натрия оксибутират
Тиопентал-натрий
Кетамин
К средствам для наркоза предъявляют определенные требования. Так, наркоз при их использовании должен наступать быстро и по возможности без стадии возбуждения. Необходима достаточная глубина наркоза, обеспечивающая оптимальные условия операции. Важным моментом является хорошая управляемость глубиной наркоза в процессе использования средств для наркоза. Желательно,

чтобы выход из наркоза был быстрым, без последействия. Это облегчает проведение посленаркозного периода.
Существенной характеристикой средств для наркоза является наркотическая широта — диапазон между концентрацией, в которой препарат вызывает наркоз, и его минимальной токсической концентрацией, при которой наступает угнетение жизненно важных центров продолговатого мозга. О наркотической широте средств для ингаляционного наркоза судят по их концентрации во вдыхаемом воздухе, а средств для неингаляционного наркоза — по вводимым дозам. Естественно, что чем больше наркотическая широта, тем безопаснее препарат. Побочные эффекты должны отсутствовать или быть минимальными.
Желательно, чтобы применение средств для наркоза технически было достаточно простым. Одно из требований заключается в безопасности препаратов в пожарном отношении: они не должны гореть и взрываться. В настоящее время это требует особого внимания, так как в операционных находится большое количество разнообразной аппаратуры, малейшая неисправность которой может стать причиной воспламенения горючих средств для наркоза. При внедрении в медицинскую практику новых препаратов следует учитывать и их стоимость. Синтез препарата должен быть экономически доступным для его выпуска в промышленных масштабах.
5.1. СРЕДСТВА ДЛЯ ИНГАЛЯЦИОННОГО НАРКОЗА
Для ингаляционного наркоза применяют летучие жидкости (фторотан, эфир для наркоза и др.), легко переходящие в парообразное состояние, а также газообразные вещества (азота закись, циклопропан). Обычно используют специальные наркозные аппараты, позволяющие создавать во вдыхаемом воздухе необходимую концентрацию веществ.
При вдыхании средств для ингаляционного наркоза они путем диффузии поступают из легких в кровь. Абсорбция препарата зависит от его концентрации во вдыхаемом воздухе, объема и частоты дыхания, поверхности и проницаемости альвеол, растворимости средств для наркоза в крови и скорости кровотока в малом круге кровообращения. Все это определяет скорость нарастания концентрации препарата в крови и тканях, от которой зависит быстрота развития наркоза.
Большинство средств для ингаляционного наркоза распределяются в организме более или менее равномерно. Некоторые различия связаны с неодинаковым кровоснабжением органов и тканей. Выделяются эти вещества легкими, в основном в неизмененном виде. Скорость элиминации зависит от тех же факторов, что и абсорбция. Особенно быстро выделяются газообразные средства для наркоза.
5.1.1. ЖИДКИЕ ЛЕТУЧИЕ ВЕЩЕСТВА
К этой группе относятся фторотан, энфлуран, изофлуран, эфир для наркоза и другие препараты.
Относительно широкое распространение в анестезиологии получил фторотан (галотан, флуотан). Фторотан относится к фторсодержащим алифатическим соединениям (см. структуру). Характеризуется высокой наркотической активностью (в 3-4 раза превосходит эфир). Наркоз наступает быстро (через 3-5 мин) с очень короткой стадией возбуждения. Введение в наркоз осуществляется фторотаном в концентрации 4 об.% (во вдыхаемом воздухе). Для поддержания наркоза достаточно ингаляции 0,5-2,5 об.% фторотана. Наркоз фторотаном легкоуправляем. При прекращении вдыхания препарата больной просыпается через 5-10 мин. Наркотическая широта фторотана значительная (аналогична таковой эфира).
Наркоз протекает с вполне удовлетворительным мышечным расслаблением. Фторотан усиливает миопаралитический эффект антидеполяризующих курареподобных средств, но в меньшей степени, чем эфир.
Для действия фторотана характерна брадикардия, связанная с повышением тонуса блуждающего нерва (предупреждается введением атропина). Артериальное давление фторотан снижает (табл. 5.2). Происходит это в результате угнетения сосудодвигательного центра и симпатических ганглиев (фторотан заметно усиливает действие ганглиоблокирующих веществ), а также прямого миотропного влияния на сосуды. При применении фторотана возможны сердечные аритмии. Они обусловлены прямым влиянием фторотана на миокард, в том числе сенсибилизацией адренорецепторов к адреналину. В связи с этим на фоне фторотанового наркоза введение адреналина, норадреналина и эфедрина противопоказано. Если возникает необходимость в прессорных веществах, то следует применять α-адреномиметики (мезатон). Фторотан угнетает секреторную активность слюнных, бронхиальных, желудочных желез. Функцию печени фторотан, по имеющимся данным, нарушает не чаще, чем другие средства для наркоза. Раздражающих свойств не имеет. Ацидоза не вызывает. Тошнота и рвота в посленаркозном периоде отмечаются редко.
В организме значительная часть фторотана (примерно 20%) подвергается биотрансформации.
Фторотан в отличие от эфира в пожарном отношении безопасен.
К фторсодержащим алифатическим соединениям относятся также энфлуран, изофлуран, десфлуран. Они несколько отличаются от фторотана по фармакокинетике и побочным эффектам. Их сравнительная характеристика по ряду параметров представлена в табл. 5.2.
Из новых фторсодержащих соединений к наиболее совершенным препаратам относится севофлуран. Он вызывает быстрое развитие наркоза, характеризуется легкой управляемостью эффекта и соответственно быстрым выходом из наркоза, не раздражает слизистые оболочки верхних дыхательных путей, отрицательное влияние на функцию внутренних органов незначительно. На сердечно-сосудистую систему, включая мозговое кровообращение, и дыхание влияет в небольшой степени. Химически препарат стабилен, обладает приятным запахом, в пожарном отношении безопасен (не горит). Используется в клинической и амбулаторной практике.
Эфир для наркоза по химическому строению представляет собой диэтиловый эфир (см. структуру). Он обладает выраженной наркотической активностью, достаточной наркотической широтой, относительно низкой токсичностью.
| Таблица 5.2 Сравнительная характеристика средств для ингаляционного наркоза | Опасность в пожарном отношении | – | – | – | ± | – | Не горит, но горение поддерживает | + | 1 В скобках в объемных процентах (об.%) дано значение минимальной альвеолярной концентрации (МАК) препаратов, в которой они у 50% пациентов устраняют двигательную реакцию на боль (например, на разрез кожи). Чем меньше величина МАК, тем выше активность препарата. 2 В скобках дано значение коэффициента распределения препарата в крови/газе (воздухе). Чем меньше значение коэффициента (и соответственно растворимости препарата в крови), тем выше скорость индукции и выхода из наркоза. Плюс — наличие эффекта; минус — его отсутствие. |
| Раздражающее действие на слизистую оболочку дыхательных путей | – | – | – | – | + | – | +++ | ||
| Влияние на сердечно-сосудистую систему и дыхание | Гипотензия; брадикардия; угнетение дыхания | Небольшая гипотензия; угнетение дыхания | Возможна тахикардия; небольшая гипотензия; угнетение дыхания | То же | Небольшая гипотензия; угнетение дыхания | Небольшая гипотензия; угнетение дыхания | |||
| Органотропность | Угнетение миокарда; сенсибилизация адренорецепторов миокарда к действию катехоламинов; возможно нарушение функции печени | То же | Практически не оказывает отрицательного влияния на внутренние органы | То же | «« | «« | Преходящее угнетение функции почек | ||
| Влияние на действие антидеполяризующих миорелаксантов | Усиливает | Усиливает | Усиливает | « | Усиливает | Не влияет | Усиливает | ||
| Миорелаксация | Хорошая | Очень хорошая | Хорошая | « | Хорошая | Не вызывает | Хорошая | ||
| Скорость индукции и выхода из наркоза2 | Средняя (2,4) | Высокая (1,9) | Высокая (1,4) | Высокая (0,68) | Очень высокая (0,45) | Очень высокая (0,47) | Низкая (12,0) | ||
| Активность1 | Высокая (0,75) | Высокая (1,6) | Высокая (1,2) | Высокая (1,7-2,05) | Средняя (6,0) | Низкая (100,0) | Средняя (1,9) | ||
| Препарат | Фторотан | Энфлуран | Изофлуран | Севофлуран | Десфлуран | Азота закись | Эфир для наркоза |
Эфирный наркоз довольно легкоуправляем, но не настолько хорошо, как наркоз, вызываемый газообразными средствами для наркоза или фторотаном.
Концентрация эфира во вдыхаемом воздухе в зависимости от способа наркотизирования и чувствительности больного обычно варьирует от 2-4 до 10-12 об.%.
При использовании эфира отчетливо выражены стадии наркоза. Стадия анальгезии характеризуется подавлением болевой чувствительности. Связано это, повидимому, с угнетением межнейронной передачи возбуждения в афферентных путях и понижением функциональной активности нейронов коры головного мозга. Сознание при этом сохранено, но ориентация нарушена. Типична амнезия.
Для эфирного наркоза характерна длительная стадия возбуждения (до 10-20 мин). Это существенно затрудняет введение в наркоз. Стадия возбуждения объясняется повышением активности подкорковых структур (в основном среднего мозга). Это связано с угнетением коры головного мозга и выключением субординационных механизмов, контролирующих состояние нижележащих центров. Сознание утрачено. Наблюдается двигательное и речевое возбуждение. Зрачки расширены. Дыхание, как правило, учащается. Отмечается тахикардия. Артериальное давление колеблется. Спинномозговые рефлексы повышаются. В связи с раздражающим действием эфира могут возникать кашель, гиперсекреция бронхиальных и слюнных желез, а при попадании эфира со слюной в желудок — рвота. Возможно также рефлекторное (с верхних дыхательных путей) урежение дыхания и ритма сердечных сокращений вплоть до апноэ и остановки сердца. Эти эффекты предупреждаются введением атропина.
В стадии хирургического наркоза происходит дальнейшее угнетение межнейронной передачи как в головном мозге, так и на уровне спинного мозга. Сознание выключено. Болевая чувствительность отсутствует. Рефлекторная активность подавлена. Вегетативные рефлексы при этом угнетены не полностью. Зрачки сужены. В стадии III1 пульс урежается (по сравнению со II стадией), артериальное давление стабилизируется, дыхание становится регулярным. При углублении наркоза частота пульса меняется, возможны сердечные аритмии, артериальное давление может снижаться. Дыхание постепенно угнетается. Отмечается хорошая релаксация скелетных мышц, облегчающая проведение операции. Миорелаксация связана не только с влиянием эфира на центральные механизмы регуляции мышечного тонуса, но и с некоторым его угнетающим действием на нервно-мышечные синапсы. Следует также учитывать, что эфир усиливает и пролонгирует блокирующий эффект на нервно-мышечную передачу антидеполяризующих курареподобных средств (см. главу 3; 3.4.2).
При применении эфира активируются центральные звенья симпатико-адреналовой системы, что приводит к выделению из надпочечников адреналина. Функции миокарда и печени, как правило, не страдают. Редко возникает быстро проходящая желтуха. Функция почек угнетается. Возможна альбуминурия. В случае глубокого наркоза развивается ацидоз (в крови накапливаются кетоновые тела).
Пробуждение после наркоза эфиром, который выделяется легкими в неизмененном виде, происходит постепенно (примерно в течение 30 мин). Однако для полного восстановления функций головного мозга требуется несколько часов. Длительно сохраняется анальгезия. В посленаркозном периоде нередко возникает рвота. Раздражающее действие эфира на слизистые оболочки дыхательных путей может быть причиной развития в послеоперационном периоде бронхопневмонии.
При передозировке препарата наступает агональная стадия, связанная с резким угнетением дыхательного и сосудодвигательного центров продолговатого мозга. Объем и частота дыхания прогрессирующе снижаются, и развивается асфикция. Возникает сердечная недостаточность, артериальное давление падает. Зрачки в агональной стадии резко расширены. Если не предпринять соответствующие меры, больной погибает от паралича дыхательного центра и последующей остановки сердца.
В определении стадий наркоза существенную роль играет ЭЭГ. При использовании эфира в I и II стадиях наркоза наблюдается десинхронизация биопотенциалов. Регистрируются частые низкоамплитудные колебания. В стадии хирургического наркоза наступает синхронизация ЭЭГ: появляются высокоамплитудные колебания, частота которых снижается по мере углубления наркоза. В агональной стадии амплитуда волн резко падает вплоть до полного исчезновения биоэлектрической активности.
Аналогичные изменения ЭЭГ характерны для большинства средств для наркоза. Однако следует учитывать, что каждому препарату присущи свои особенности в динамике ЭЭГ на разных стадиях наркоза.
5.1.2. ГАЗООБРАЗНЫЕ ВЕЩЕСТВА
К этой группе относятся азота закись, циклопропан, этилен. Наибольшее распространение в медицинской практике получил первый препарат.
Азота закись (N2O) побочных эффектов в течение операции в используемых концентрациях не вызывает. Не обладает раздражающими свойствами. Отрицательного влияния на паренхиматозные органы не оказывает. Основной недостаток азота закиси — низкая наркотическая активность. N2O вызывает наркоз лишь в концентрации 94-95% во вдыхаемом воздухе. Использовать такие концентрации невозможно, так как при этом наступает резкая гипоксия. В связи с этим в анестезиологии обычно применяют смесь 80% азота закиси и 20% кислорода. При этом выражена анальгезия, но не развивается необходимая глубина наркоза и отсутствует достаточная релаксация скелетной мускулатуры. В лучшем случае эффект достигает начального уровня стадии хирургического наркоза. Исходя из этого, N2O обычно сочетают с другими, более активными препаратами (например, с фторотаном). Для получения необходимой релаксации скелетных мышц азота закись нередко комбинируют с курареподобными веществами. Прекращение ингаляции N2O приводит к быстрому пробуждению без явлений последействия. Выделяется препарат легкими в неизмененном виде. В послеоперационном периоде нередко возникают тошнота и рвота.
Применяют азота закись не только для ингаляционного наркоза при хирургических вмешательствах, но и при инфаркте миокарда и других состояниях, сопровождающихся сильными болями. В этом случае препарат используют в течение многих часов. Однако при этом необходимо учитывать, что длительная ингаляция азота закиси может вызывать лейкопению, мегалобластическую анемию, нейропатию. Связано это с окислением кобальта в молекуле витамина В12, что приводит к нарушению активности метионинсинтетазы, участвующей в синтезе ДНК. Поэтому не следует использовать азота закись для анальгезии слишком длительное время. Кроме того, возможность таких побочных эффектов следует учитывать и применительно к медицинскому персоналу, работающему в операционных, где часто применяют N2O.
Азота закись сама не воспламеняется, но горение поддерживает.
5.2. СРЕДСТВА ДЛЯ НЕИНГАЛЯЦИОННОГО НАРКОЗА
Средства для неингаляционного наркоза обычно применяют парентерально, реже — энтерально. Из парентеральных путей их введения наибольшее распространение получил внутривенный. Существующие препараты для внутривенного наркоза по продолжительности действия могут быть представлены следующими группами:
1) кратковременного действия (продолжительность наркоза при внутривенном введении до 15 мин) — пропанидид, пропофол, кетамин;
Date: 2015-07-01; view: 620; Нарушение авторских прав