
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электроды сравнения
|
|
Это электроды, потенциалкоторых практически постоянен, легко воспроизводим и не зависит от протекания каких-либо реакций в исследуемой системе. Общепринятым электродом сравнения является стандартный водородный электрод, потенциал которого условно принят за ноль в стандартных условиях. Однако, этот электрод сравнения неудобен в работе, поэтому на практике в качестве электрода сравнения обычно используют хлорсеребряный электрод. Хлорсеребряный электрод состоит из серебряной проволоки или пластинки с нанесенным слоем хлорида серебра, погруженный в насыщенный раствор КСl (учебник Ершова, с.474), схематично этот электрод изображают так:
Аg, AgCl | КСlнас.. Потенциал хлорсеребряного электрода зависит от концентрации хлорид-ионов в растворе:
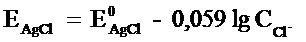
В насыщенном растворе KCl потенциал постоянная величина при постоянной температуре.
Электроды определения (индикаторные)
Электродом определения называется электрод, потенциал которого зависит от концентрации анализируемых ионов и практически не зависят от содержания других ионов в растворе.
Для измерения величины рН необходимы электроды, потенциал которых зависит от концентрации ионов водорода. Первичным стандартным электродом для определения рН является водородный электрод. Потенциал водородного электрода линейно зависит от величины рН:
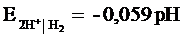
Однако для серийных измерений он не применяется в силу громоздкой конструкции и чувствительности к посторонним веществам и каталитическим ядам.
Наиболее широко в практике рН-метрни применяется стеклянный электрод (учебник Ершова, с.476). Между нонами Н+ в растворе и ионами Н+ в стекле существует равновесие:

 H+р-р H+стекло
H+р-р H+стекло
На границе раздела стекло-водный раствор возникает скачок потенциала, который возрастает с увеличением концентрации ионов водорода в растворе:
Естекл. = Е 0 + 0,059 lg СH + = Е 0 - 0,059 рН.
Стеклянные электроды применяются для измерения концентрации ионов водорода в любых средах и при любых условиях. Они обладают рядом достоинств для измерения рН в биологических средах, поскольку не чувствительны к окислительно-восстановительным процессам, не адсорбируют белки, индифферентны к поверхностно-активным веществам.
В зависимости от того, где определяется концентрация ионов (внутри или вне клетки) используются различные конструкции стеклянных электродов.
Date: 2015-07-17; view: 3918; Нарушение авторских прав