
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гальванические элементы
|
|
Гальваническим элементом называется система, в которой химическаяэнергия окислительно-восстановительного процесса превращаетсявэлектрическую. При этом процессы окисления и восстановления в системе пространственно разделены. Примером гальванической системы может служить элемент Якоби-Даниэля (учебник Ершова, с.465). Он состоит из цинкового и медного электродов, опущенных в растворы солей этих металлов. Между растворами имеется пористая перегородка.
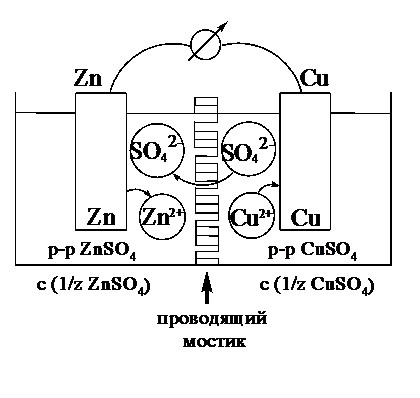 (рис.4)
(рис.4)
Нацинковомэлектроде происходит переход ионов цинка с электрода в раствор; протекаетреакцияокисления:
 Zn - 2e Zn2+
Zn - 2e Zn2+
В результате растворения цинковой пластинки увеличивается концентрация ионов цинка в растворе.
Намедномэлектроде протекает реакциявосстановления:
 Cu2+ - 2e Cu
Cu2+ - 2e Cu
В результате этого концентрация ионов меди в растворе уменьшается. При замыкании полюсов элемента проводником (внешняя цепь) электроны переходят по нему с цинковой пластины на медную. Т.к. в приэлектродном пространстве цинкового электрода раствор обогащается ионами цинка, а медного электрода - обедняется ионами меди, то сульфат-ионы перемещаются через пористую перегородку из раствора сульфата меди в раствор сульфата цинка (внутренняя цепь). Возникает замкнутый контур электрического тока.
Электрический ток, возникающий в гальваническом элементе, обусловлен суммарной окислительно-восстановительной реакцией:
 Zn + Cu2+ Cu + Zn2+
Zn + Cu2+ Cu + Zn2+
Электрохимические процессы, лежащие в основе действия элемента Якоби-Даниэля схематично можно представить так:
Zn Cu
Окисление Восстановление
(отдача электронов, (прием электронов,
образование катионов) разрядка катионов)
В гальванической цепи условно различают катод и анод.
Анодом называется электрод, на котором протекает процесс окисления, т.е. отдачи электронов.
Вгальваническойцепианодзаряженотрицательно. Он посылает электроны во внешнюю цепь.
Катодом называется электрод, на котором протекает процесс восстановления, т.е. присоединение электронов.
Вгальваническойцепикатодзаряженположительно. Он принимает электроны из внешней цепи.
При условном обозначении гальванических цепей анод записывают слева, катод справа (правило «правого полюса»), границу раздела между проводниками I рода и II рода изображают одной вертикальной чертой, границу раздела между двумя проводниками 2-го рода изображают двумя вертикальными чертами (учебник Ершова, с.466):
(-) Анод | Анодный раствор || катодный раствор | Катод (+)
Элемент Якоби-Даниэля схематично можно представить так:
(-) Zn | ZnSO4 || CuSO4 | Cu(+)
анод катод
или
(-) Zn | Zn+2 || Cu+2 | Cu(+)
Если составлять гальваническую цепь из двух металлических электродов, то тот металл, который распложен правее в электрохимическом ряду напряжений, будет катодом (+), а левее - анодом (-).
Способность гальванической цепи к переносу электрических зарядов характеризуется электродвижущей силой (ЭДС). ЭДС гальванической цепи определяется как разность потенциалов катода и анода:
ЭДС = ЕK - ЕA.
ЭДС гальванического элемента всегда положительная величина. Чем дальше отстоят друг от друга металлы в ряду стандартных электродных потенциалов, тем больше будет ЭДС построенного из них гальванического элемента.
Date: 2015-07-17; view: 700; Нарушение авторских прав