
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения типовых задач.
|
|
Пример 1. Расчет энергии связи.
Задача 1. Вычислите энергию связи H-S в молекуле H2S по следующим данным: 2H2 (г) + S2 (г) = 2 H2S (г) – 40,30 кДж; энергии связей D(H-H) и D(S-S) соответственно равны –435,9 кДж/моль и – 417,6 кДж/моль.
Решение. Образование двух молекул H2S можно представить как последовательный процесс разрыва связей H-H в молекуле H2 и связей S-S в молекуле S2:
2 H-H 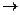 4 Н
4 Н  – 2D(H-H)
– 2D(H-H)
S-S 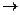 2 S
2 S  – D(S-S)
– D(S-S)
4 Н  + 2 S
+ 2 S 
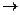 2 H2S + 4D(S-H),
2 H2S + 4D(S-H),
где D(H-H), D(S-S) и D(S-H) – энергии образования связей H-H, S-S и S-Н соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению
2H2 (г) + S2 (г) = 2 H2S (г) –2D(H-H) – D(S-S) + 4D(S-H).
Тепловой эффект этой реакции равен
Q = –2D(H-H) – D(S-S) + 4D(S-H), откуда
D(S-H) =  .
.
Пример 2. Вычисление длины связи.
Задача 1. Рассчитайте длину связи в молекуле HBr, если межъядерное расстояние в молекулах Н2 и Br2,равны 0,74 ∙ 10-10 и 2 ,28 ∙ 10-10м соответственно.
Решение. Длина ковалентной связи между двумя разноименными атомами равна сумме их ковалентных радиусов
l(H-Br) = r(H) + r(Br).
В свою очередь, ковалентный радиус атома определяется как половина межъядерного расстояния в молекулах Н2 и Br2:
 .
.
Таким образом,

Пример 3. Определение вида гибридизации орбиталей и пространственной структуры молекулы.
Задача 1. Какой вид гибридизации электронных облаков имеет место в атоме кремния при образования молекулы SiF4? Какова пространственная структура этой молекулы?
Решение. В возбужденном состоянии структура внешнего энергетического уровня атома кремния следующая:
| 3s | 3p | ||
| ↑ | ↑ | ↑ | ↑ |
| 3s | 3px | 3py | 3pz |
В образовании химических связей в атоме кремния участвуют электроны третьего энергетического уровня: один электрон в s-состоянии и три электрона в р-состоянии. При образовании молекулы SiF4 возникают четыре гибридных электронных облака (sp3-гибридизациия). Молекула SiF4 имеет пространственную тетраэдрическую конфигурацию.
Пример 4. Определение валентностей элементов в химических соединениях на основе анализа графических электронных формул основного и возбужденных состояний атомов этих элементов.
Задача 1. Какую валентность, обусловленную неспаренными электронами, может проявлять сера в основном и в возбужденном состоянии?
Решение. Распределение электронов внешнего энергетического уровня серы …3s23p4 с учетом правила Гунда имеет вид:
| s | p | d | |||||||
| 16S | ↑↓ | ↑↓ | ↑ | ↑ |
Атомы серы имеют свободные d-орбитали, поэтому возможен переход спаренных 3р- и 3s- электронов на 3d подуровень, что приводит к двум возбужденным состояниям:
| s | p | d | |||||||
| 16S | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| s | p | d | |||||||
| 16S | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
Из анализа основного и двух возбужденных состояний следует, что валентность (спинвалентность) серы в нормальном состоянии равна двум, в первом возбужденном состоянии – четырем, во втором – шести.
Пример 5. Использование метода молекулярных орбиталей (МО) для описания строения молекул.
Задача 1. а) Обоснуйте радикальный характер молекулы оксида азота (II) с помощью метода МО.
Решение. Молекула NO образуется путем взаимодействия атомных орбиталей внешних электронов атомов азота и кислорода, т.е. 2s- и 2p- орбиталей. Со стороны каждого атома во взаимодействии участвуют 4 орбитали (одна 2s- и три 2р-орбитали). Следовательно, при общем количестве взаимодействующих орбиталей, равном восьми, образуется 8 молекулярных орбиталей. При этом взаимодействие двух 2s-орбиталей атомов азота и кислорода приводит к одной σS-связывающей и одной σS*-разрыхляющей орбитали. Аналогично, взаимодействие двух 2р-орбиталей этих атомов дает одну σр-связывающую и одну σр*-разрыхляющую орбиталь. Взаимодействие четырех остающихся р-орбиталей (по две от каждого атома) приводит к образованию двух связывающих и двух разрыхляющих π- орбиталей. Изложенные соображения иллюстрируются следующей схемой образования МО:
| · :N · · _↑__↑_ _↑_ 2р 2р 2р _↑↓_ 2s |
NO
___
_↑_ σр* ______
  _↑↓__↑↓_
_↑↓__↑↓_
  _↑↓_
σр
_↑↓_
σs*
_↑↓_
σs
_↑↓_
σр
_↑↓_
σs*
_↑↓_
σs
| · :O: · _↑↓__↑_ _↑_ 2р 2р 2р _↑↓_ 2s |
В соответствии с порядком заполнения МО (в первую очередь заполняются МО с меньшей энергией) произведено размещение электронов, ранее находящихся на внешнем уровне атомов N и O, на молекулярные орбитали NO. Можно видеть, что, во-первых, взаимодействие р-орбиталей приводит к энергетическому минимуму, обусловливающему статичность молекулы NO; во-вторых, на одной из разрыхляющих π*-орбиталей находится один электрон, обусловливающий радикальный характер молекулы NO.
Задача 2. б) Обоснуйте с помощью метода МО, почему гелий является одноатомным газом.
Решение. Представим себе образование двухатомной молекулы гелия через взаимодействие 1s орбиталей его атомов 2He. Такое взаимодействие приводит к образованию одной связывающей σ-орбитали и одной разрыхляющей σ*-орбитали. Представим это взаимодействие схемой:

| 
| |
| _↑↓_ 1s | _↑↓_ σs* _↑↓_ σs | _↑↓_ 1s |
Можно видеть, что размещение принадлежащих атомам гелия четырех электронов не приводит к общему понижению энергии (формированию энергетического минимума), так как стабилизация, достигнутая при заполнении связывающей МО, теряется при заполнении разрыхляющей МО. Поэтому 2 атома гелия не могут удерживаться в молекулярной структуре He2.
Пример 6. Оценка энергий МО межмолекулярных взаимодействий на основе температуры кипения соединений.
Задача 1. Объясните наблюдаемые различия в температурах кипения у следующей группы соединений с близкой молекулярной массой.
| Соединение | Ткип,оС |
| CH3CH2CH2CH3 | |
| CH3CH2OCH3 | |
| CH3CH2CHO | |
| CH3CH2CH2OH |
Решение. Н-бутан содержит в своей структуре атомы углерода в sp3-состоянии и атомы водорода, близкие по своей электроотрицательности и слабо поляризуемые. Это обусловливает слабость сил диполь-дипольного, индукционного и дисперсионного взаимодействий между молекулами и неустойчивость молекулярных ассоциатов. В метилэтиловом эфире появляются предпосылки для дисперсионных взаимодействий из-за более высокой неполяризуемости атома этого ряда по сравнению с углеродом. Из-за полярности связей С–О увеличивается по сравнению с н-бутаном сила диполь-дипольных и индукционных взаимодействий. Молекула пропионового альдегида характеризуется сильно полярной связью С=О из-за дополнительного смещения π-электронов к электроотрицательному атому кислорода. Это обусловливает возрастание по сравнению с метилэтиловым эфиром сил индукционного и диполь-дипольного взаимодействия и общее упрочнение межмолекулярных связей, что требует более высокой энергии для разрыва этих связей, т.е. более высокой температуры кипения. Наконец, в молекуле спирта появляются структурные предпосылки для образования более прочных по сравнению с Ван-дер-Ваальсовыми взаимодействиями водородных связей: наличие кислого водорода связи Н–О и электроотрицательного атома кислорода.
··· Н – О ·· Н – О ··· Н – О ···
| | |
R R R
Разрыв таких связей в процессе испарения требует еще большей энергии, и, соответственно, более высокой температуры.
Date: 2016-11-17; view: 470; Нарушение авторских прав